题目内容
L—T 5种短周期元素的信息如下表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
A.与稀盐酸反应的剧烈程度:L单质<Q单质
B.热稳定性:H2T<H2R
C.沸点:H2T>H2R
D.L2+与R2-的核外电子数相等
C
解析试题分析:根据题目提供的元素的原子半径及化合价的信息可知:L是Mg;M是Al;Q是Be;R是S;T是O。A.由于金属性Mg>Al,所以与稀盐酸反应的剧烈程度:L单质>Q单质。错误。B.非金属性O>S,所以热稳定性:H2T热稳定性:H2T>H2R 。错误。C.H2O、H2S是同种元素形成的化合物,一般情况下结构相似的物质,相对分子质量越大,物质的分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,即物质的熔沸点就越高沸点。但是由于O的电负性大而原子半径又小,所以在水分子之间还存在氢键,增加了分子间的相互作用力,使其熔沸点较高。因此沸点:H2O>H2S。正确。D.Mg2+核外电子排布是2、8,而S2-的核外电子排布是2、8、8.因此电子数不相等。错误。
考点:考查元素周期表、元素周期律的知识。

香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电了数是次外层的3倍,T无正价,X与R原了序数之和是W的2倍。下列说法错误的是
| A.原子半径:Y>Z>R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物碱性:X>Z |
| D.XR2、WR2两化合物中R的化合价相同 |
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
| A.所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
| B.一个分子中共含有15个σ键 |
| C.属于极性分子,故极易溶于水 |
| D.分子内既有极性键又有非极性键 |
下列物质的沸点逐渐升高的是
| A.NH3 PH3 AsH3 SbH3 | B.Si SiC H2O CO2 |
| C.NaI NaBr NaCl NaF | D.Li Na K Rb |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角。下列判断正确的是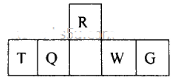
| A.离子半径:T< W<G |
| B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C.最简单气态氢化物的热稳定性:Q<R |
| D.T和G组成的化合物溶于水,其水溶液呈中性 |
下列各微粒中,各个电子层电子数都达到2n2个的是
| A.Ne、Ar | B.Al3+、S2- | C.F-、Na+ | D.He、Cl- |
下列比较错误的是
| A.原子半径:N>O>F |
| B.酸性强弱:HNO3>H3PO4>H2SO4 |
| C.碱性强弱:KOH >NaOH>Mg(OH)2 |
| D.氢化物的稳定性:HF>HCl>H2S |
短周期元素X、Y、Z关系如图,X原子的电子层数为n,最外层电子数为2n。W原子最内层电子数是最外层电子数的2倍。下列说法错误的是
| X | | | |
| | | Y | Z |
A.X 和Y都是非金属元素,其中X最高化合价为+5价
B.X、W的最高价氧化物在一定条件下能反应
C.元素X、W和氧元素可形成化学式为W2XO3共价化合物
D.Y、Z的氢化物的稳定性:Y<Z
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| | | R | | |
| T | Q | | W | G |
B.最简单气态氢化物的热稳定性:
C.最高价氧化物对应水化物的酸性:Q >W>G
D.T和G组成的化合物甲溶于水,其水溶液呈中性