题目内容
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+CO2 (gCO(NH2)2 (l)+H2O (l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①△H(填“>”、“<”或“=”)0.
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ![]() ,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
,如图是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是 .
③图中的B点处,NH3的平衡转化率 为 . 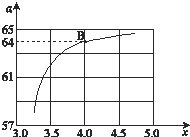
【答案】<;NH3的量增大,平衡正向移动,则增大CO2的转化率;32%
【解析】解:①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,所以答案是:<; ②2NH3 (g)+CO2 (g)CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,二氧化碳转化率增大, 所以答案是:NH3的量增大,平衡正向移动,则增大CO2的转化率; ③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率= ![]() ×100%=32%,
×100%=32%,
所以答案是:32%.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

练习册系列答案
相关题目