题目内容
15.25℃时,下列有关曲线与对应的叙述正确的是( )| A. |  表示不同温度下,水溶液中H+和OH-的浓度变化,温度a>b | |
| B. |  表示30%H2O2在60℃时分解率与pH关系,说明pH越大H2O2分解率越大 | |
| C. | 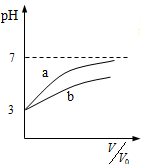 表示体积均为V0、pH均为3的盐酸和醋酸稀释时的pH变化,a表示盐酸 | |
| D. |  是等浓度NaCl和NaI溶液分别用AgNO3溶液滴定,则Ksp(AgI)>Ksp(AgCl) |
分析 A.水的离子积常数为Kw=c(H+)•c(OH-),水的电离过程是吸热反应,温度升高,有利于促进水的电离;
B.随着pH升高,H2O2的分解率并不是直线上升;
C.盐酸是强酸,溶液中的n(H+)保持不变,随着稀释进行,溶液中c(H+)下降很快;
D.当加入等体积的AgNO3溶液中,难溶性的沉淀中平衡时阴离子浓度更小.
解答 解:A.水的离子积常数为Kw=c(H+)•c(OH-),水的电离过程是吸热反应,温度升高,有利于促进水的电离,水的离子常数变大,根据图象分析,则温度b>a,故A错误;
B.根据图象分析,随着pH升高,H2O2的分解率并不是直线上升,在pH=9之后,甚至出现了下降,因此并不是纯粹的pH越大H2O2分解率越大,故B错误;
C.盐酸是强酸,溶液中的n(H+)保持不变,随着稀释进行,溶液中c(H+)下降很快,则pH值随着稀释上升的很快,根据图象,a表示盐酸,故C正确;
D.当加入等体积的AgNO3溶液中,难溶性的沉淀中平衡时阴离子浓度更小,根据图象分析,平衡时-lg(I-)>-lgc(Cl-),则c(I-)<c(Cl-),AgCl和AgI是同类型沉淀,所以Ksp(AgI)<Ksp(AgCl),故D错误.
故选C.
点评 本题考查了水的离子积常数,溶液的pH,沉淀溶解平衡,溶度积常数,考查的是综合运用化学知识的能力,均为高频考点,题目难度不大.

练习册系列答案
相关题目
6.下列叙述不正确的是( )
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
3.下列说法中,正确的是( )
| A. | 煤和石油主要组成元素均为碳、氢元素,二者都是混合物 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 煤的液化主要是为了得到苯等重要的有机化工原料 | |
| D. | 煤的气化是物理变化,目的是获取高效、清洁的燃料 |
20.下列判断错误的是( )
| A. | 稳定性:NH3>PH3>AsH3 | B. | 原子半径:N>P>As | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
7.天然碱的组成可以用aNa2CO3•bNaHCO3•cH2O(a、b、c为整数)表示.现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式.
(1)将质量为31.0g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生2.24L(标准状况)CO2和5.4g水.天然碱A的化学式中:a=1,b=2,c=2,
(2)已知Na2CO3与稀盐酸的反应分下列两步进行:Na2CO3+HCl→NaCl+NaHCO3,NaHCO3+HCl→NaCl+CO2↑+H2O,将质量为12.45g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如表所示:
①由表中数据可推测加入50mL盐酸时,产生气体的体积为1120mL(标准状况);盐酸的浓度为2.5mol•L-1;天然碱B的化学式为:2Na2CO3•NaHCO3•2H2O.
②若取W g的天然碱B加入到30mL该浓度的盐酸中,则请用W表示产生产生气体体积V(标准状况,单位:mL)
(1)将质量为31.0g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生2.24L(标准状况)CO2和5.4g水.天然碱A的化学式中:a=1,b=2,c=2,
(2)已知Na2CO3与稀盐酸的反应分下列两步进行:Na2CO3+HCl→NaCl+NaHCO3,NaHCO3+HCl→NaCl+CO2↑+H2O,将质量为12.45g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如表所示:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
②若取W g的天然碱B加入到30mL该浓度的盐酸中,则请用W表示产生产生气体体积V(标准状况,单位:mL)
4.关于苯分子结构的研究经历了很长时间,著名科学家凯库勒最先提出了凯库勒结构式,并较好地解释了苯的一些性质.但随着理论研究的不断深入,杂化轨道理论可以更好地来解释苯分子的结构和性质.以下有关苯分子结构的说法,错误的是( )
| A. | 苯分子中每个碳原子的原子轨道都发生sp2杂化,形成夹角为120°的三个sp2杂化轨道 | |
| B. | 乙烷、乙烯、乙炔分子中,碳原子轨道杂化方式和苯相同的只有乙烯 | |
| C. | 苯分子中存在6个C-C σ键和6个C-H σ键 | |
| D. | 每个碳原子的一个sp2杂化轨道采用“肩并肩”的方式重叠,形成一个大π键 |
3. 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
已知:p Ag+=-lgc(Ag+),Ksp(AgI)=8.0×10-17,Ksp(AgBrI)=5.0×10-13,Ksp(AgCl)=1.8×10-10.下列说法正确的是( )
 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:已知:p Ag+=-lgc(Ag+),Ksp(AgI)=8.0×10-17,Ksp(AgBrI)=5.0×10-13,Ksp(AgCl)=1.8×10-10.下列说法正确的是( )
| A. | 三种溶液各取10 mL混合,然后滴定,沉淀先后顺序为Cl-、Br-、I- | |
| B. | 滴定Cl-时,可加人少量的KI作指示剂 | |
| C. | 当滴定AgNO3溶液至70.00mL时,溶液中c(I-)>c (Br-)>c(Cl-) | |
| D. | 滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液 |



