题目内容
1.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.(1)提出假设:
①该反应的气体产物是CO2;
②该反应的气体产物是CO;
③该反应的气体产物是CO2、CO的混合物.
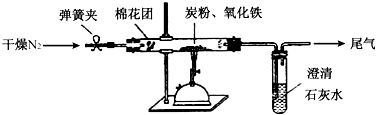
(2)计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
(3)查阅资料:
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.
请写出该反应的离子方程式:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O.
(4)实验步骤:
①按如图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2,其作用分别为步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收.
(5)数据处理:
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑.
(6)实验优化:
学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M(BaCO3)>M(CaCO3),称量时相对误差小.
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:在尾气出口处加一点燃的酒精灯或增加一尾气处理装置.
分析 (1)根据过量炭粉与氧化铁反应的气体产物可能有①CO、②CO2、③CO2、CO的混合物得出假设③;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应可以制得氮气;
(4)⑤根据前后两次通入氮气的时间和减小实验误差角度来分析;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)①根据氢氧化钙和氢氧化钡的本质区别进行分析;
②一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物,则假设③为:CO2、CO的混合物,
故答案为:CO2、CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O,
故答案为:NH4++NO2-$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(4)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气,最后确保完全吸收,反应后还要赶出所有的CO2,
故答案为:步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收;
(5)3.20g氧化铁的物质的量为=$\frac{3.2g}{160g/mol}$=0.02mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=$\frac{2.0g}{100g/mol}$=0.02mol,m(CO2)=0.02mol×44g/mol=0.88g,
反应后硬质玻璃管和固体总质量变化为1.44g大于0.88g,则生成其气体为CO2、CO的混合物,混合气体中含有CO0.08mol,所以CO、CO2的混合气体物质的量比为4:1,所以方程式为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑,
故答案为:2C+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+CO↑+CO2↑;
(6)①由于氢氧化钡的溶解度大于氢氧化钙,将澄清石灰水换成Ba(OH)2溶液,这样会使二氧化碳被吸收的更完全,同时由于钡的相对原子质量比钙大,所以称量时相对误差小,
故答案为:Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M (BaCO3)>M(CaCO3),称量时相对误差小;
②一氧化碳是一种有毒气体,可以通过点燃进行尾气处理,
故答案为:在尾气出口处加一点燃的酒精灯或增加一尾气处理装置.
点评 本题主要考查的是物质组成与含量的测定、性质实验方案的设计,题目难度中等,涉及离子反应方程式、化学方程式书写、环境保护、实验方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验、化学计算能力.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
| A. | 8:3 | B. | 3:8 | C. | 27:4 | D. | 4:27 |
| A. | SO2、SiO2、CO2均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 福尔马林、水玻璃、氢氟酸、小苏打均为纯净物 |
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| B. | 1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 | |
| C. | 7.8gNa2O2与过量水反应转移电子数为0.1NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,△H变为-46.2kJ•mol-1 |
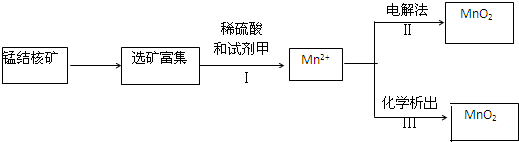
 营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是: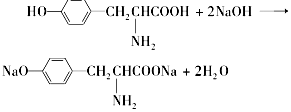 .
.