题目内容
下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D
等浓度的CH3COONa溶液和Na2CO3溶液,由于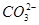 的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
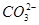 的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
练习册系列答案
相关题目
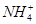 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、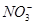 、
、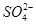 ,已知:
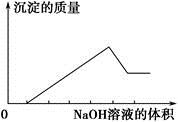
,已知: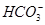 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是