题目内容
【题目】(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
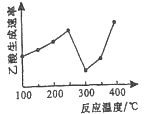
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
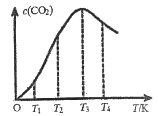
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】 728 kJmol-1 催化剂活性降低(或催化剂中毒等) 升高温度或增大压强等 BC 放热 40% 0.02a mol·min-1
【解析】(1)已知:①![]() 130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②
130KJ/mol,②2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1。根据盖斯定律,将②![]() 3/2-①得:
3/2-①得:![]() ,即△H=(-572 kJ·mol -1
,即△H=(-572 kJ·mol -1![]() 3/2)-( -130kJ·mol-1)
3/2)-( -130kJ·mol-1)
=728 kJmol-1故![]() 的燃烧热为728 kJmol-1
的燃烧热为728 kJmol-1
(2)①催化剂的活性与温度有关,当温度在![]() 范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低。答案:催化剂活性降低(或催化剂中毒等)
②欲使乙酸的平衡产率提高,应该使平衡正向移动。因为正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高; 增大压强,平衡正向移动,乙酸的平衡产率提高;答案:升高温度或增大压强等
(3)①由2CO(g)![]() C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
C(s)+CO2(g)。是两边气体体积数不等的反应,根据质量守恒定律
A.容器内混合物的质量不变不能作为判断平衡的依据,故A错;B.CO和CO2的物质的量之比不再变化说明CO和CO2的量不在改变,能作为判断平衡的标志;C.混合气体的平均摩尔质量是物质的质量比上物质的摩尔质量,根据方程式混合气体的平均摩尔质量不再变化,可以作为判断平衡的依据; 故C对;D. 根据2CO(g)![]() C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC
C(s)+CO2(g)CO CO2分别在等号的两侧,形成amolC=O键的同时形成2amolC![]() O键,所以D错;答案为B C。
O键,所以D错;答案为B C。
②向某恒容容器中通入一定量的CO发生上述反应,2CO(g)![]() C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
C(s)+CO2(g),平衡后升高温度,CO2量逐渐减少,说明该反应是放热反应。答案;放热。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
2CO(g)![]() C(s)+CO2
C(s)+CO2
初始物质的量 a 0 0
变化的物质的量 2x x x
平衡物质的量 a-2x x x
达平衡,CO的体积分数为75%,所以![]() =75% x=0.2a CO的平衡转化率=2
=75% x=0.2a CO的平衡转化率=2![]() 0.2a/a
0.2a/a![]() = 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
= 40%。0-10min内平均反应速率v(CO2)=0.2amol/10min = 0.02a mol·min-1.答案:
. 40% 0.02a mol·min-1。

 阅读快车系列答案
阅读快车系列答案