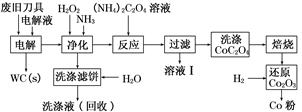
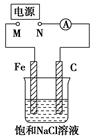
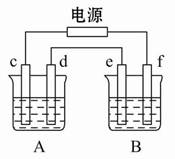
题目内容
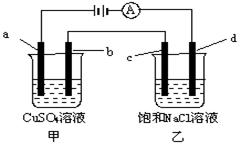
用惰性电极电解NaCl和CuSO4混合液250 mL,经过一段时间后,两极均得到11.2 L气体(标准状况下),则下列有关描述中,正确的是( )
| A.阳极发生的反应只有:4OH--4e-=2H2O+O2↑ |
| B.两极得到的气体均为混合气体 |
| C.若Cu2+起始浓度为1 mol·L-1,则c(Cl-)起始为 2 mol·L-1 |
| D.Cu2+的起始物质的量应大于0.5 mol |
C
阳极一开始是Cl-放电,然后OH-放电,A错;根据放电顺序,在阴极,一开始Cu2+放电,不产生气体,后来只有H+放电产生0.5 mol H2,B错;若Cu2+起始浓度为1 mol·L-1,则阴极共通过1.5 mol e-,阳极生成11.2 L气体(标准状况下),转移1.5 mol e-,设氯气的物质的量为x,氧气的物质的量为y,则x+y="0.5" mol,2x+4y="1.5" mol,解得,x="y=0.25" mol,C对;根据极限思维,若阳极产生的0.5 mol气体全是氧气会转移2 mol e-,因有氯气产生,故转移的电子小于2 mol,阴极产生的氢气转移电子1 mol,故产生铜的过程中转移电子小于1 mol,故Cu2+的起始物质的量应小于0.5 mol,D错。

练习册系列答案
相关题目
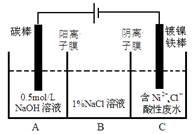
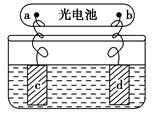
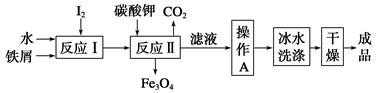
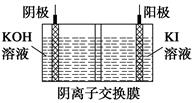
 4Al+3O2↑
4Al+3O2↑