题目内容
【题目】84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
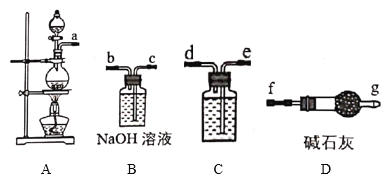
(1)A中发生反应的离子方程式为___。
(2)C中盛装试剂为__,仪器的连接顺序为a→__。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__(填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__![]() 。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品![]() ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 e→d→c→b→f→g 减小 放阴暗处、避免碰撞、不能放在易燃物附近、密封 7956 CH3COOH+H2O2=CH3COOOH+H2O 19.00%
Mn2++Cl2↑+2H2O 饱和食盐水 e→d→c→b→f→g 减小 放阴暗处、避免碰撞、不能放在易燃物附近、密封 7956 CH3COOH+H2O2=CH3COOOH+H2O 19.00%
【解析】
I.本实验的目的是制备NaClO,氯气和NaOH溶液反应可以生成NaClO和NaCl,所以需要先制备氯气,装置A中利用浓盐酸和二氧化锰共热制取氯气,生成的氯气中会混有HCl气体,需要除去,可以用装置C盛放饱和食盐水进行洗气,洗气后通入NaOH溶液进行反应,未反应的氯气有毒,可以用装有碱石灰的干燥管进行吸收;
(7)该滴定实验的原理是先用高锰酸钾将双氧水氧化,然后利用过氧乙酸氧化碘离子生成碘单质,之后利用Na2S2O3标准溶液滴定生成的碘单质的量,从而确定过氧乙酸的量。
(1)装置A中利用浓盐酸和二氧化锰共热制取氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)C装置盛装饱和食盐水除去氯气中混有的杂质,根据分析可知仪器的连接顺序为a→e→d→c→b→f→g;
(3)次氯酸钠受热易分解,所以温度过高产率减小;
(4)过氧乙酸易溶于水、易分解、易爆炸、对人体有害,所以贮存和运输时应放阴暗处、避免碰撞、不能放在易燃物附近、密封;
(5)稀释过程溶质的质量不变,设加水的体积为V,水的密度为1g/cm3,所以有200mL×1.02g·cm-3×20%=(200mL×1.02g·cm-3+V×1g·cm-3)×0.5%,解得V=7956mL;
(6)根据元素守恒可知H2O2和CH3COOH制备过氧乙酸的化学方程式为CH3COOH+H2O2=CH3COOOH+H2O;
(7)消耗Na2S2O3溶液20.00mL,其浓度为1.500mol·L-1,根据反应方程式I2+2Na2S2O3=2NaI+Na2S4O6可知生成的碘单质的物质的量n(I2)=![]() =0.015mol,根据化学方程式2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2可知,消耗的过氧乙酸的物质的量n(CH3COOOH)= n(I2)=0.015mol,所以样品中过氧乙酸的质量分数为
=0.015mol,根据化学方程式2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2可知,消耗的过氧乙酸的物质的量n(CH3COOOH)= n(I2)=0.015mol,所以样品中过氧乙酸的质量分数为![]() =19.00%。
=19.00%。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
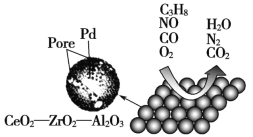
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
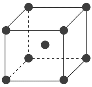
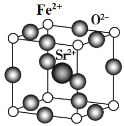
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。