题目内容
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
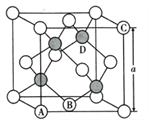
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
【答案】 7 2p3 sp、sp2 SCN-、CO2、 CS2、N3- 等中的任一种 NH4F F的电负性更大, F原子半径比I原子小,H-F键比H-I键强(H-F更易形成),F-更易夺取NH4+中的H 3 (3/4,3/4,3/ 4) NA=336/(a3d)×1021
【解析】(1). N是7号元素,核外电子排布式为1s22s22p3,则N原子核外有7种不同运动状态的电子,基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为2p3,故答案为:7;2p3;
(2). 经测定发现N2O5固体由NO2+和NO3-两种离子组成,NO2+的中心N原子价层电子对数为:2+![]() =2,杂化方式为sp,NO3-的中心N原子价层电子对数为:3+
=2,杂化方式为sp,NO3-的中心N原子价层电子对数为:3+![]() =3,杂化方式为sp2,NO2+所含的原子数为3、价电子数为16,根据等电子体原理,与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-等,故答案为:sp、sp2;SCN-、CO2、CS2、N3-等中的任一种;
=3,杂化方式为sp2,NO2+所含的原子数为3、价电子数为16,根据等电子体原理,与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-等,故答案为:sp、sp2;SCN-、CO2、CS2、N3-等中的任一种;
(3). NH4F受热分解生成NH3和HF,NH4I受热分解生成NH3和HI,因F原子半径比I原子小,且F元素的电负性更大,H-F键比H-I键更易形成,F-更易夺取NH4+中的H原子,所以NH4F更易分解,故答案为:NH4F;F的电负性更大,F原子半径比I原子小,H-F键比H-I键强(H-F更易形成),F-更易夺取NH4+中的H;
(4). 同一周期从左至右,元素的第一电离能呈增大趋势,因B元素的s能级为全充满的稳定状态,N元素的p能级为半充满的稳定状态,二种元素的第一电离能高于同周期相邻元素的第一电离能,则第一电离能介于B元素和N元素之间的有Be、C、O三种元素,故答案为:3;
(5).①.原子坐标参数:A为(0,0,0)、B为(1/2,1/2,0)、C为(1,0,1),由晶胞示意图可知,D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,由立体几何知识可知,D原子的坐标参数为(3/4,3/4,3/4),故答案为:(3/4,3/4,3/4);
②. 由晶胞示意图可知,Ga位于顶点和面心,N位于体内,根据均摊法,在一个晶胞中,含有Ga的个数为8×1/8+6×1/2=4,含有N的个数为4,氮化镓晶胞的边长为anm,则晶胞密度![]() =
=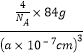 = dg/cm3,NA=
= dg/cm3,NA=![]() ×1021,故答案为:
×1021,故答案为:![]() ×1021。
×1021。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
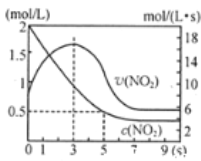
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。