题目内容
16.用括号内的试剂和操作除去下列各物质中的少量杂质,其中正确的是( )| A. | 溴苯中的少量溴单质(NaOH溶液、分液) | |
| B. | 溴乙烷中的乙酸(NaOH溶液、蒸馏) | |
| C. | 乙醇中的水(生石灰、过滤) | |
| D. | 苯中含有少量苯酚(溴水、过滤) |
分析 A、单质溴能与NaOH溶液反应生成溴化钠、次溴酸钠和水;
B、加入NaOH溶液蒸馏,不但能反应掉乙酸,也会反应掉溴乙烷;
C、生石灰和水反应生成的氢氧化钙仍能溶于乙醇;
D、苯酚和溴水生成的三溴苯酚为有机物,而有机物之间绝大多数可以互溶.
解答 解:A、单质溴能与NaOH溶液反应生成溴化钠、次溴酸钠和水,溴化钠、次溴酸钠溶于水,溴苯不能NaOH溶液反应也不溶于NaOH溶液,出现分层现象,可用分液的方法分离,既除去了杂质,又没有引入新的杂质,符合除杂原则,故A正确;
B、加入NaOH溶液蒸馏,不但能反应掉乙酸,还会引起溴乙烷的水解反应,故B错误;
C、生石灰和水反应生成的氢氧化钙仍能溶于乙醇,故不能用过滤的方法,应该采用蒸馏的方法,故C错误;
D、苯酚和溴水生成的三溴苯酚为有机物,而有机物之间绝大多数可以互溶,故生成的三溴苯酚仍然溶于苯中,又引入新杂质,故D错误.
故选A.
点评 本题主要主要考查了物质的除杂,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键.

练习册系列答案
相关题目
18.某地酸雨经检验除含H+外[C(OH)-以及其他微量的离子浓度忽略]还有Na+,Cl-,NH4+,SO42-其浓度见表:
(1)试计算混合液中H+的浓度3.5×10-3mol•L-1.
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
| 离子种类 | Na+ | Cl- | NH4+ | SO42- |
| 离子浓度 | 2.3×10-5mol/L | 3.5×10-5mol/L | 7×10-6mol/L | 2.4×10-6mol/L |
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
7.华裔科学家高锟发明的光导纤维被称为信息时代的神经.光导纤维属于( )
| A. | 无机非金属材料 | B. | 金属材料 | C. | 有机高分子材料 | D. | 复合材料 |
4.某有机物M的结构简式如下: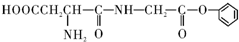 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )
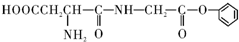 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )| A. | M的分子式为:C12H15O5N2 | |
| B. | M可以发生水解反应、中和反应、加成反应、消去反应 | |
| C. | M的水解产物中一定含有醇类 | |
| D. | 1 molM最多可以与1L4mol/L的NaOH溶液完全反应 |
1.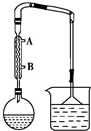 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
回答下列问题:
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.
 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
| 物质 | 颜色、状态 | 沸点(℃) | 密度(g•mL-1) | 水溶性 |
| 正丁醇 | 无色液体 | 117.2 | 0.8098 | 易溶 |
| 1-溴丁烷 | 无色液体 | 101.6 | 1.2758 | 难溶 |
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.
5.下列微粒中与OH-离子具有不同的质子数和相同的电子数的是( )
| A. | F- | B. | O2- | C. | Cl- | D. | K+ |
6.一定条件下,建立平衡2NO2(g)?N2O4(g),以下说法正确的是( )
| A. | 恒温恒容,再充入NO2,达到新平衡时,NO2的体积分数增大 | |
| B. | 恒温恒容,再充入N2,达到新平衡时,容器内颜色变浅 | |
| C. | 恒温恒容,再充入N2O4,达到新平衡时,混合气体的平均相对分子质量增大 | |
| D. | 恒温恒压,再充入Ar,达到新平衡时,NO2的转化率降低 |
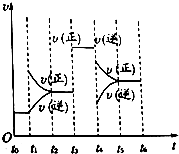 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题: