题目内容
【题目】氮元素的氢化物和氧化物在工业生产和防建设中都有广泛的应用.请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2(g)2NH3(g)反应过程的能量变化如图所示:已知1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1molN﹣H键时释放390.8kJ的能量. 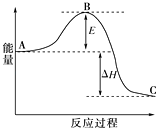
①图中E的大小对该反应热有无影响? . 该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低? , 理由 .
②图中△H=kJ/mol.
③如果反应速率v(H2)为0.15mol/(Lmin),则v(N2)=mol/(Lmin),v(NH3)= .
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:N2(g)+2O2(g)=N2O4(l)?△H=﹣19.5kJmol﹣1
N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=﹣534.2kJmol﹣1
请写出肼和 N2O4反应的热化学反应方程式 .
【答案】
(1)无影响;降低;催化剂参与反应,改变了反应路径,降低反应的活化能;﹣94.8;0.05;0.1mol/(L?min)
(2)2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=﹣1049.9kJ/mol
【解析】解:(1)①因图中A、C分别表示反应物总能量、生成物总能量,而E为反应的活化能,由于反应热的大小取决于反应物和生成物的总能量的相对大小,故E的大小对反应热无影响;加入催化剂,改变了反应路径,使反应的活化能减小,即B点降低.所以答案是:无影响;降低;催化剂参与反应,改变了反应路径,降低反应的活化能;②根据反应N2(g)+3H2(g)2NH3(g)结合1molN2分子中的化学键断裂时需要吸收942kJ的能量、1molH2分子中的化学键断裂时需要吸收436kJ的能量、形成1molN﹣H键时释放390.8kJ的能量,可知,反应的反应热△H=942kJ/mol+3×436kJ/mol﹣390.8kJ/mol×6=﹣94.8KJ/mol,
所以答案是:﹣94.8KJ/mol;③由于v(H2)=0.15mol/(Lmin),而化学反应速率之比等于系数之比,故v(N2)= ![]() v(H2)=0.05mol/(Lmin),v(NH3)=2v(N2)=0.1mol/(Lmin),所以答案是:0.05;0.1mol/(Lmin);(2)已知①N2(g)+2O2(g)═N2O4(l),△H=﹣19.5kJ/mol;②N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=﹣534.7kJ/mol;利用盖斯定律将②×2﹣①可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),△H=(﹣534.7kJ/mol)×2﹣(﹣19.5kJ/mol)=﹣1049.9kJ/mol,
v(H2)=0.05mol/(Lmin),v(NH3)=2v(N2)=0.1mol/(Lmin),所以答案是:0.05;0.1mol/(Lmin);(2)已知①N2(g)+2O2(g)═N2O4(l),△H=﹣19.5kJ/mol;②N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=﹣534.7kJ/mol;利用盖斯定律将②×2﹣①可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),△H=(﹣534.7kJ/mol)×2﹣(﹣19.5kJ/mol)=﹣1049.9kJ/mol,
所以答案是:2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=﹣1049.9kJ/mol.
【考点精析】根据题目的已知条件,利用反应速率的定量表示方法的相关知识可以得到问题的答案,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.

 阅读快车系列答案
阅读快车系列答案