题目内容
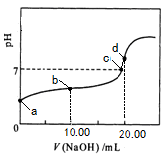
室温下,取0.2 mol·L-1CH3COOH溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(H+)=10-8 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 |
| D.混合溶液中c(OH-)-c(CH3COOH)=c(H+)=1×10-8 mol·L-1 |
D
混合后反应恰好生成CH3COONa,溶液pH=8说明水解显碱性,盐的水解促进水的电离,A错误。溶液中CH3COO-水解,浓度减小,所以c(Na+)>c(CH3COO-),B错误。混合后溶液稀释1倍,c(Na+)=0.1 mol/L,C错误。因CH3COO-+H2O??CH3COOH+OH-,水解产生的OH-和CH3COOH相等。所以,c(OH-)-c(CH3COOH)是水电离出的c(OH-)与c(H+)相等,D正确。

练习册系列答案
相关题目


 溶液②与
溶液②与 溶液③混合,若
溶液③混合,若 ,则混合溶液pH=4(忽略溶液体积变化)
,则混合溶液pH=4(忽略溶液体积变化)