题目内容
(10分)现有ag铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请回答相应问题。
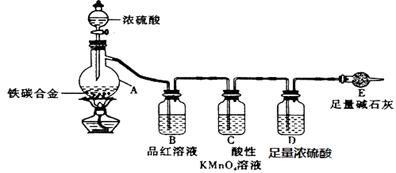
(1)未点燃酒精灯前,A、B均无明显现象,其原因是:____ _。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出碳与浓硫酸加热反应的化学方程式_____________________________________。
(3)待A中不再逸出气体时停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。能用该方法测定的前提现象是 。
(4)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_______(填写代号)。
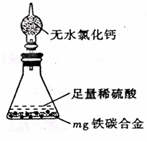
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量。

(1)未点燃酒精灯前,A、B均无明显现象,其原因是:____ _。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出碳与浓硫酸加热反应的化学方程式_____________________________________。
(3)待A中不再逸出气体时停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。能用该方法测定的前提现象是 。
(4)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_______(填写代号)。

A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量。
(10分)(1)常温下,碳和铁不与浓硫酸反应
(2)C+2H2SO4(浓)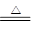 CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O
(3)(11a-3b)/11a C中紫色未褪尽
(4)C (每空2分)
(2)C+2H2SO4(浓)
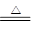 CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O(3)(11a-3b)/11a C中紫色未褪尽
(4)C (每空2分)
(1)浓硫酸具有强氧化性,但在常温下,碳和铁不与浓硫酸反应,所以A、B中没有明显的现象。
(2)在加热的条件下,碳被浓硫酸氧化生成CO2,同时浓硫酸被还原生成SO2,反应的方程式是C+2H2SO4(浓)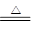 CO2↑+SO2↑+2H2O。
CO2↑+SO2↑+2H2O。
(3)由于反应中生成的SO2被B、C吸收,水蒸气被浓硫酸吸收,所以E中吸收的是CO2,即CO2的物质的量是b/44mol,因此原合金中碳的质量是12b/44g。所以铁碳合金中铁的质量分数为 =(11a-3b)/11a。能用该方法测定的前提是SO2完全被B、C吸收,所以实验现象是C中紫色未褪尽,即说明SO2已经完全被吸收。
=(11a-3b)/11a。能用该方法测定的前提是SO2完全被B、C吸收,所以实验现象是C中紫色未褪尽,即说明SO2已经完全被吸收。
(4)由于排水法测量氢气的体积不易操作,且误差较大,选项A不正确;B中操作太繁琐,不正确;由于碳和稀硫酸不反应,而铁能和稀硫酸反应生成氢气,所以通过测定反应前后装置和药品的总质量即可以得出氢气的质量,进而得出铁的质量,所以正确的答案选C。
(2)在加热的条件下,碳被浓硫酸氧化生成CO2,同时浓硫酸被还原生成SO2,反应的方程式是C+2H2SO4(浓)
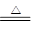 CO2↑+SO2↑+2H2O。
CO2↑+SO2↑+2H2O。(3)由于反应中生成的SO2被B、C吸收,水蒸气被浓硫酸吸收,所以E中吸收的是CO2,即CO2的物质的量是b/44mol,因此原合金中碳的质量是12b/44g。所以铁碳合金中铁的质量分数为
 =(11a-3b)/11a。能用该方法测定的前提是SO2完全被B、C吸收,所以实验现象是C中紫色未褪尽,即说明SO2已经完全被吸收。
=(11a-3b)/11a。能用该方法测定的前提是SO2完全被B、C吸收,所以实验现象是C中紫色未褪尽,即说明SO2已经完全被吸收。(4)由于排水法测量氢气的体积不易操作,且误差较大,选项A不正确;B中操作太繁琐,不正确;由于碳和稀硫酸不反应,而铁能和稀硫酸反应生成氢气,所以通过测定反应前后装置和药品的总质量即可以得出氢气的质量,进而得出铁的质量,所以正确的答案选C。

练习册系列答案
相关题目
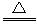 CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)