题目内容
9.(1)现有如下几种有机物:①乙醇 ②苯酚 ③苯甲醛 ④丙酮 ⑤环己烷以上有机物中可以和金属钠反应的有①②(填编号,下同),可以发生银镜反应的有③;写出②与溴水反应的化学方程式
 .
.(2)用系统命名法命名:
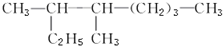 3,4-二甲基-庚烷.
3,4-二甲基-庚烷.(3)现有某有机物A,欲推断其结构,进行如下实验:取15g A 完全燃烧生成22g CO2和9g H2O,该有机物的实验式为CH2O;质谱仪检测得该有机物的相对分子质量为90,则该物质的分子式为C3H6O3.
分析 (1)含-OH、-COOH的有机物与Na反应;含-CHO的有机物发生银镜反应;苯酚与溴水反应生成白色沉淀;
(2)主链含8个C,3、4号C上有甲基;
(3)结合n=$\frac{m}{M}$计算22gCO2和9gH2O的物质的量,根据质量守恒计算有机物中O元素质量,进而计算n(O),再根据原子守恒确定最简式;结合该有机物的相对分子质量为90确定分子式.
解答 解:(1)以上有机物中可以和金属钠反应的有乙醇、苯酚,可以发生银镜反应的有苯甲醛,苯酚与溴水反应的化学方程式为 ,故答案为:①②;③;
,故答案为:①②;③; ;
;
(2)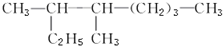 中主链含8个C,3、4号C上有甲基,则系统命名为3,4-二甲基-庚烷,故答案为:3,4-二甲基-庚烷;
中主链含8个C,3、4号C上有甲基,则系统命名为3,4-二甲基-庚烷,故答案为:3,4-二甲基-庚烷;
(3)二氧化碳的物质的量为$\frac{22g}{44g/mol}$=0.5mol,则n(C)=0.5mol,m(C)=0.5mol×12g/mol=6g,
水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,则n(H)=1mol,m(H)=1mol×1g/mol=1g,
根据质量守恒可知,15gA中氧元素质量为15g-6g-1g=8g,则n(O)=$\frac{8g}{16g/mol}$=0.5mol,
故有机物A分子中N(C):N(H):(O)=0.5mol:1mol:0.5mol=1:2:1,A的最简式为CH2O,
该有机物的相对分子质量为90,则设分子式为(CH2O)n,n=$\frac{90}{30}$=3,则分子式为C3H6O3,
故答案为:CH2O;C3H6O3.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团及分子式计算的确定方法为解答的关键,侧重分析、推断及计算能力的考查,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
20.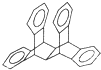 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |
4.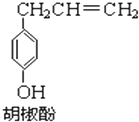 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ③④⑤ |
14.下列各组物质,一定互为同系物的是( )
| A. | 符合同一通式的物质 | |
| B. | 含有相同官能团的物质 | |
| C. | 相对分子质量相差14或者14的倍数的物质 | |
| D. | 通式为CnH2n+2,且C原子数不相等的物质 |
1.四种短周期元素的离子aXm+、bYn+、cZn-、dRm-,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm->Zn-
⑥X一定可与冷水反应.
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm->Zn-
⑥X一定可与冷水反应.
| A. | 只有②正确 | B. | ①②③④正确 | C. | ①②③⑥正确 | D. | ②③⑤正确 |
19.下列三种有机物是某些药物中的有效成分.以下说法正确的是( )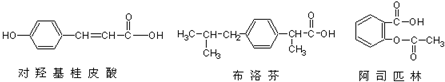

| A. | 三种有机物都能与浓溴水发生反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将1mol 的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 | |
| D. | 使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |


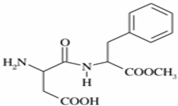 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.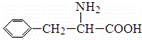 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: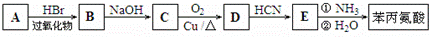
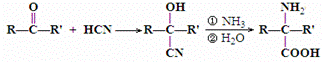
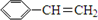

 .
.