题目内容
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:

另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
【答案】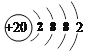
![]() CaFeC2O6(或CaCO3·FeCO3) CaCO3·FeCO3△CaO+FeO+2CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2FeO+CO2△Fe2O3+CO 检验Fe2O3:将固体加入盐酸溶解,再滴入KSCN溶液,溶液呈血红色;检验CO:将气体产物通过灼烧CuO,黑色固体变为红色
CaFeC2O6(或CaCO3·FeCO3) CaCO3·FeCO3△CaO+FeO+2CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2FeO+CO2△Fe2O3+CO 检验Fe2O3:将固体加入盐酸溶解,再滴入KSCN溶液,溶液呈血红色;检验CO:将气体产物通过灼烧CuO,黑色固体变为红色
【解析】
由白色沉淀在空气中可转化为红褐色沉淀知X中含有铁元素,由X与盐酸反应生成气体甲,一般与盐酸反应产生气体的物质中含有CO32-或HCO3-,甲又能与溶液1反应生色沉淀且该白色沉淀又可在水中继续与甲反应,故甲是CO2。由实验过程知X中含有+2价的铁,X中含有4种元素,若X中含有HCO3-和Fe,则X分解的产物有3种,与题意不符,所以应含有CO32-,另一种金属可能是+2价的钙,根据化合价写出X的化学式为CaFe(CO3)2,X分解得到CO2、CaO、FeO。固体1是CaO、FeO的混合物,溶于水后得氢氧化钙溶液和固体2为FeO,氢氧化钙与二氧化碳反应生成碳酸钙沉淀,所以沉淀1是碳酸钙;FeO与盐酸反应生成氯化亚铁,无氧条件下与氢氧根离子反应生成氢氧化亚铁沉淀,空气中转化为氢氧化铁。据此分析解答。
(1)根据以上分析,白色沉淀1的金属原子是Ca,其原子结构示意图为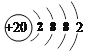 ,CO2的电子式为
,CO2的电子式为![]() ;
;
(2)X为CaFeC2O6(或CaCO3·FeCO3),X分解得到CO2、CaO、FeO,化学反应方程式为CaCO3·FeCO3△CaO+FeO+2CO2↑;
(3)白色沉淀2是Fe(OH)2,红褐色沉淀是Fe(OH)3,变色的原因是4Fe(OH)2+O2+2H2O===4Fe(OH)3;
(4)固体1是CaO和FeO的混合物,由于铁元素处于中间价态,可以升高也可以降低,CO2中碳元素处于最高价态,只能降低,因此可能的化学反应方程式为2FeO+CO2△Fe2O3+CO。验证该反应的产物:将固体粉末溶于稀盐酸,滴入KSCN溶液若显红色,则可证明产物中有Fe3+;将气体产物通入灼烧的氧化铜固体中,固体变红色,且反应后气体通入澄清石灰水溶液变浑浊,则证明气体产物是CO。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)可作半导体材料的元素是 ______(填元素符号);气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐的元素是 _____(填名称);
(2)第三周期中离子半径最小的是___________(填离子符号);
(3)① ~ ⑨的最高价氧化物的水化物中:酸性最强的是 __________(填化学式);碱性最强的是________(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为__________。
(4)⑧、⑨可形成A2B2型的化合物,分子中二者均满足8电子稳定结构,则其电子式为_________________。
【题目】某研究性学习小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),甲同学设计实验如下表:
实验编号 | 盐酸浓度(mol·L-1) | 铁的状态 | 温度/°C |
1 | 2.00 | 块状 | 20 |
2 | 2.00 | 粉末 | 20 |
3 | 1.00 | 块状 | 20 |
4 | 2.00 | 块状 | 40 |
请回答:
(1)若四组实验均以收集到500mL(已转化为标准状况下)氢气为标准,则上述实验中还需要测定的数据是________。
(2)实验________和______是研究铁的状态对该反应速率的影响(填实验编号,下同);实验______和______是研究温度对该反应速率的影响。
(3)测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线c、d分别对应的实验组别可能是_______、______。

(4)乙同学设计了下列一组实验:所用铁块的形状、质量均相同,所用酸的体积相同,其浓度如下,你认为产生氢气速率最快的是______。
A 18.4mol·L-1硫酸 B 5.0mol·L-1硝酸 C 3.0mol·L-1盐酸 D 2.0mol·L-1硫酸



