题目内容
【题目】下列物质中,互为同系物的有________,互为同分异构体的有________,互为同素异形体的有________,属于同位素的有________,是同一种物质的有________。
① ![]() ;②白磷;③ 2,3﹣二甲基丁烷;④
;②白磷;③ 2,3﹣二甲基丁烷;④ ![]() ;⑤
;⑤ ![]() ;⑥红磷;⑦
;⑥红磷;⑦![]() ;⑧
;⑧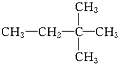
【答案】①⑧或④⑧ ③⑧ ②⑥ ⑤⑦ ①④
【解析】
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;具有相同分子式而结构不同的化合物互为同分异构体;同种元素形成的不同单质互为同素异形体;质子数相同质量数(或中子数)不同的原子互称同位素;组成和结构都相同的物质为同一物质,同一物质组成、结构、化学性质都相同,结构式的形状及物质的聚集状态可能不同。
⑧与①或与④的结构相似,在分子组成上相差一个CH2,所以①⑧或④⑧互为同系物;
③为2,3﹣二甲基丁烷,⑧为2,2﹣二甲基丁烷,互为同分异构体;
②白磷与⑥红磷是磷元素组成的不同单质,属同素异形体;
⑤![]() 与⑦
与⑦![]() 的质子数都是17,质子数相同,中子数分别是18、20,中子数不同,是同一元素的不同的原子,二者属于同位素;
的质子数都是17,质子数相同,中子数分别是18、20,中子数不同,是同一元素的不同的原子,二者属于同位素;
① ![]() 和④
和④ ![]() 属于同种物质。
属于同种物质。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目