题目内容
下列反应属于吸热反应的是( )
A.炭燃烧生成一氧化碳 B.Ba(OH )2·8H2O与NH4Cl反应
)2·8H2O与NH4Cl反应
C.锌粒与稀硫酸反应制取H2 D.中和反应
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案下列说法正确的是
A.分了数不同的CO与N2的体积一定不等
B.体枳相同的CO与N:的质量相等
C.质量相同、密度不同的CO与凡N2所含的原了数目—定相等
D.质量不同、密度相同的CO与N2所含分了数可能相同
“一器多用”可实现多方面的化学实验探究,某课外活动小组学生利用图15所示的仪器组合(省略夹持和净化装置)来完成下列实验,回答下列问题:
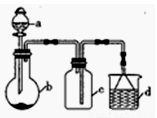
(1)仪器a的名称为______________,仪器a在使用前要________________。
(2)该装置可用于某些气体的制取、收集及尾气处理裝置,下表中3个实验的设计方案合理的是_________________(填序号)
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 稀硝酸 | Cu | NO | H2O |
B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
C | 浓氨水 | NaOH固体 | NH3 | H2O |
(3)氨气和氯气接触时会产生白烟,请写出相应的化学方程式:_______________________。
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取SO2。
①下列装置可用于SO2尾气处理的是(夹持仪器已略去)_____________(填序号)。
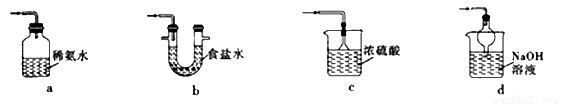
用Fe2(SO4)3溶液也可吸收多余的SO2气体.写出SO2与Fe2(SO4)3溶液反应的离子方程式:_______________________。
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4·xH2O)中结晶水x的值,各次 称量的数据如下表:
称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
则胆矾应放在____________(填仪器名称)中加热;必须要进行恒重操作的原因是__________________;CuSO4·xH2O中的x=___________(保留1位小数);若测定结果x偏大,可能的原因是____________(填序号)。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却


 .使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣ bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )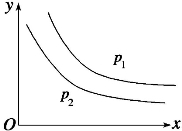
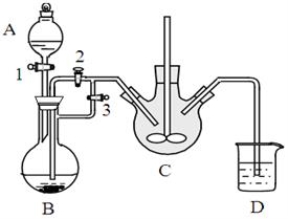
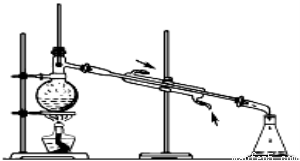
 银球应放在 位置,以测量蒸汽的温度。
银球应放在 位置,以测量蒸汽的温度。