题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属活动性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为____________;可观察到的实验现象是________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)呼吸面具的原理:________________,_______________________。
(4)填写a、b、c化学式并书写①、②的离子方程式(a、b、c均为含Al化合物);
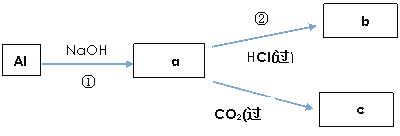
a:____________,b:_____________,c:____________;
①____________________________________________;
②____________________________________________;
【答案】强 2Na+2H2O=2Na++2OH-+H2↑ bc 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 NaAlO2 AlCl3 Al(OH)3 2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+4H+=Al3++2H2O
【解析】
(1)根据金属活动性顺序进行分析;
(2)依据钠的物理性质及钠与水反应产物解答,钠化学性质活泼,与水反应生成氢氧化钠和氢气,钠的密度小于水,钠和水剧烈反应且放出大量热,钠的熔点较低;
(3)利用过氧化钠制取氧气的化学性质可应用于呼吸面具,其原理是过氧化钠和二氧化碳、水蒸气反应生成氧气;
(4)根据“铝三角”之间的转化关系分析作答。
(1)在金属活动性顺序表中,钠排在铝之前,故钠比铝活泼,钠比铝易失电子,即钠元素的金属活动性比铝的强,
故答案为:强;
(2)钠化学性质活泼,与水发生置换反应,钠密度小于水,熔点低,浮在水面,钠与水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;反应放热,使钠熔化成小球,产生的氢气推动钠四处游动,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;b c;
(3)过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2;
(4)①为铝和氢氧化钠溶液反应的过程,其离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,则a为NaAlO2,②为生成的偏铝酸钠与过量的盐酸反应的过程,其离子方程式为:AlO2-+4H+=Al3++2H2O,则b为AlCl3,又因二氧化碳溶于水形成弱酸碳酸,而偏铝酸钠与二氧化碳反应时只会生成氢氧化铝沉淀,沉淀不会被溶解,故c为Al(OH)3,
故答案为:NaAlO2;AlCl3;Al(OH)3;2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+4H+=Al3++2H2O。