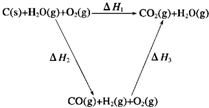
题目内容
将等质量的Mg分别在下列三种气体中完全燃烧,所得固体质量分别为W1、W2、W3,三者间的关系是( )
①氧气 ②空气 ③二氧化碳
A.W1=W3>W2 B.W2>W3>W1
C.W3>W1>W2 D.W2>W1>W3
答案:C
解析:
解析:
镁是活泼的金属,可在O2、N2、CO2、Cl2等气体中燃烧。本题根据有关反应式比较生成固体质量的大小。 镁在三种气体中燃烧(为简便起见设Mg均为6mol)
从上式看出,等质量的Mg燃烧所得固体质量,在CO2中最大,在氮气中最小;而空气中CO2含量太小,忽略不计,由于氮气的参与使得Mg在空气中燃烧所得固体质量小于在纯氧中燃烧所得固体质量。所以应选C。
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目