题目内容
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为pgcm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
A. ![]()
B. ![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5![]()
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
【答案】B
【解析】
溶质的质量分数为W可由溶质的质量和溶液的质量来计算;根据c=![]() 来计算;水的密度比氨水的密度大,相等体积的氨水与水相比,水的质量较大,等体积混合后溶液的质量大于原氨水的2倍,而溶液中氨气的质量相同;根据反应后的溶质及水解来分析。
来计算;水的密度比氨水的密度大,相等体积的氨水与水相比,水的质量较大,等体积混合后溶液的质量大于原氨水的2倍,而溶液中氨气的质量相同;根据反应后的溶质及水解来分析。
VmL氨水,溶液的密度为pgcm-3,溶液的质量为pVg,溶质的质量为![]() ×17,则溶质的质量分数为W=
×17,则溶质的质量分数为W=![]() ×100%,A错误;溶质的物质的量为
×100%,A错误;溶质的物质的量为![]() mol,溶液的体积为VmL,则c=
mol,溶液的体积为VmL,则c=![]() mol/L,B正确;水的密度比氨水的密度大,相等体积的氨水与水相比,水的质量较大,故等体积混合后溶液的质量大于原氨水的2倍,故等体积混合所得溶液溶质的质量分数小于0.5W,C错误;VmL氨水,再加入VmL同浓度稀盐酸,充分反应后生成氯化铵,氯化铵水解使溶液显酸性,由于水解的程度比较小,故溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),D错误。
mol/L,B正确;水的密度比氨水的密度大,相等体积的氨水与水相比,水的质量较大,故等体积混合后溶液的质量大于原氨水的2倍,故等体积混合所得溶液溶质的质量分数小于0.5W,C错误;VmL氨水,再加入VmL同浓度稀盐酸,充分反应后生成氯化铵,氯化铵水解使溶液显酸性,由于水解的程度比较小,故溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),D错误。
故选B。

 名校课堂系列答案
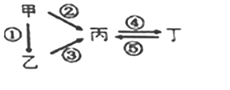
名校课堂系列答案【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
【题目】将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )

A | B | C | D | |
X | 碳酸氢钡溶液 | 碳酸钠溶液 | 氢氧化钾溶液 | 二氧化碳气体 |
Y | 氢氧化钠溶液 | 氯化钙溶液 | 硫酸氢镁溶液 | 石灰水 |
A. A B. B C. C D. D