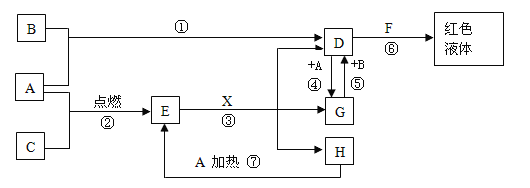
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)⑧的气态氢化物为_________(填电子式)
(2)⑤对应的碱为_____(填电子式);③的最高价含氧酸_____(填化学式)。
(3)比较⑤、⑥元素的金属性强弱________;并写出它们最高价氧化物的水化物反应的化学方程式__________。
(4)写出一种由原子序数①、③、⑧三种元素组成化合物的化学式:_______。
【答案】![]()
![]() HNO3 Na>Al NaOH+Al(OH)3==NaAlO2+2H2O NH4Cl
HNO3 Na>Al NaOH+Al(OH)3==NaAlO2+2H2O NH4Cl
【解析】
由元素周期表的结构可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素。
(1)⑧为Cl元素,Cl元素的气态氢化物为HCl,H原子和Cl原子之间通过形成1对共用电子对结合,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。
(2)⑤为Na元素,Na元素对应的碱为NaOH,NaOH中钠离子和氢氧根离子间通过离子键相结合,氢氧根离子中氧原子和氢原子间通过共价键相结合,电子式为![]() ,③为N元素,N元素的最高价含氧酸为HNO3,故答案为:
,③为N元素,N元素的最高价含氧酸为HNO3,故答案为:![]() ,HNO3。
,HNO3。
(3)⑤、⑥元素分别为Na、Cl,同一周期元素的金属性从左向右逐渐减弱,所以金属性Na>Al,Na元素的最高价氧化物的水化物为NaOH,Al元素的最高价氧化物的水化物为Al(OH)3,氢氧化钠和氢氧化铝反应生成偏铝酸钠和水,反应方程式为:NaOH+Al(OH)3==NaAlO2+2H2O,故答案为:Na>Al,NaOH+Al(OH)3==NaAlO2+2H2O。
(4)①、③、⑧三种元素分别为H、N、Cl,这三种元素组成化合物的化学式为NH4Cl,故答案为:NH4Cl。

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目