题目内容
【题目】下列说法不正确的是( )
A.标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移电子总数为0.1mol
B.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,所以明矾可用于水的净化
C.向Na2CO3溶液中滴加盐酸溶液,一定有CO2气体生成
D.Na2O2常用于潜水艇或呼吸面具的供氧剂
【答案】C
【解析】
A.标况下,![]() 氯气的物质的量为
氯气的物质的量为![]() ,Cl2+2NaOH= NaCl+NaClO+H2O,1mol氯气与过量的氢氧化钠溶液反应,转移了1mol电子,
,Cl2+2NaOH= NaCl+NaClO+H2O,1mol氯气与过量的氢氧化钠溶液反应,转移了1mol电子,![]() 氯气与过量的氢氧化钠溶液反应,转移了
氯气与过量的氢氧化钠溶液反应,转移了![]() 电子,故A正确;
电子,故A正确;
B.明矾水溶液中,铝离子水解生成的氢氧化铝胶体能吸附水中悬浮物,具有净水作用,故B正确;
C.向![]() 溶液中滴加少量的盐酸溶液生成碳酸氢钠溶液,没有二氧化碳生成,故C错误;
溶液中滴加少量的盐酸溶液生成碳酸氢钠溶液,没有二氧化碳生成,故C错误;
D.过氧化钠和二氧化碳生成碳酸钠和氧气,所以![]() 常用于潜水艇或呼吸面具的供氧剂,故D正确;
常用于潜水艇或呼吸面具的供氧剂,故D正确;
答案选C。

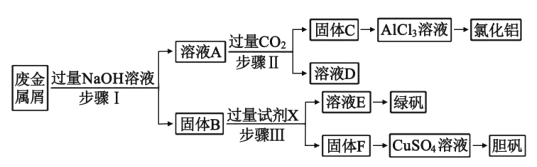
【题目】【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。