题目内容
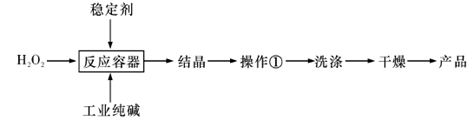
过碳酸钠(2Na2CO4·3H2O)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下:
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液显 (填“酸性”、“碱性”或“中性”)。请用离子方程式表示:______________________。
(2)操作①需要的玻璃仪器有 (填写仪器名称)。
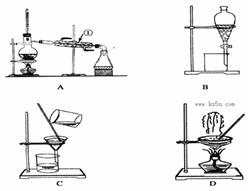
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

①要检验工业纯碱中杂质的存在,最好选用下列试剂中的__________(选填序号)。
a. 氢氧化钡溶液 b. 稀硝酸 c. 硫氰化钾溶液 d. 硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若观察到 说明装置不漏气。
③装置A的作用是 ,装置C中的试剂为 。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要? (选填“必要”或“不必要”),判断的理由是 。

试回答下列问题:
(1)过碳酸钠溶于水后所得溶液显 (填“酸性”、“碱性”或“中性”)。请用离子方程式表示:______________________。
(2)操作①需要的玻璃仪器有 (填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。

①要检验工业纯碱中杂质的存在,最好选用下列试剂中的__________(选填序号)。
a. 氢氧化钡溶液 b. 稀硝酸 c. 硫氰化钾溶液 d. 硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若观察到 说明装置不漏气。
③装置A的作用是 ,装置C中的试剂为 。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要? (选填“必要”或“不必要”),判断的理由是 。
(1) 碱性(1分) CO42– + H2O  HCO4– + OH–
HCO4– + OH–
(2)漏斗(1分) 烧杯(1分) 玻璃棒(1分)
(3) ①bd ②漏斗内的水面高于瓶内的水面,且保持一段时间不变 ③吸收空气中的CO2,避免干扰,并赶走装置中滞留的气体 浓硫酸(1分) ④必要(1分) 避免空气中的CO2进入D装置,提高实验的准确性
 HCO4– + OH–
HCO4– + OH–(2)漏斗(1分) 烧杯(1分) 玻璃棒(1分)
(3) ①bd ②漏斗内的水面高于瓶内的水面,且保持一段时间不变 ③吸收空气中的CO2,避免干扰,并赶走装置中滞留的气体 浓硫酸(1分) ④必要(1分) 避免空气中的CO2进入D装置,提高实验的准确性
试题分析:(1)过碳酸钠大量用于洗涤,可推测其显碱性,因为过碳酸根离子水解呈碱性:CO42– + H2O
 HCO4– + OH–。(2)从溶液中分离出晶体,在实验室应采用过滤的方法,过滤操作需要的玻璃仪器漏斗、烧杯、玻璃棒。(3)①检验纯碱中是否含量有NaCl杂质,应先加入AgNO3溶液,再加入过量的稀HNO3,若仍有白色溶液,说明溶液中含有Cl–,故选bd;②漏斗内的水面高于瓶内的水面,且保持一段时间不变,则说明装置不漏气;③本实验设计原理为通过测定生成的CO2的质量确定纯碱中Na2CO3的含量,所以B装置内滞留的气体应能被D装置中的碱石灰充分吸收,设计A装置的目的就是通过鼓入空气赶走B装置中滞留的气体,但又不能让空气中的CO2影响测定结果,因此A装置中所盛溶液必须能除去空气中的CO2,设计C装置的目的是除去CO2中混合的水蒸气,故装置A的作用是:吸收空气中的CO2,并赶走装置中滞留的气体,装置C中的试剂为:浓硫酸;④定量实验应尽量精确,减小误差,实验中需要称量的是实验前后D装置的质量,如果空气中的CO2进入D装置会造成实验误差,影响实验的精确度,所以D装置后必须连接一个E装置。
HCO4– + OH–。(2)从溶液中分离出晶体,在实验室应采用过滤的方法,过滤操作需要的玻璃仪器漏斗、烧杯、玻璃棒。(3)①检验纯碱中是否含量有NaCl杂质,应先加入AgNO3溶液,再加入过量的稀HNO3,若仍有白色溶液,说明溶液中含有Cl–,故选bd;②漏斗内的水面高于瓶内的水面,且保持一段时间不变,则说明装置不漏气;③本实验设计原理为通过测定生成的CO2的质量确定纯碱中Na2CO3的含量,所以B装置内滞留的气体应能被D装置中的碱石灰充分吸收,设计A装置的目的就是通过鼓入空气赶走B装置中滞留的气体,但又不能让空气中的CO2影响测定结果,因此A装置中所盛溶液必须能除去空气中的CO2,设计C装置的目的是除去CO2中混合的水蒸气,故装置A的作用是:吸收空气中的CO2,并赶走装置中滞留的气体,装置C中的试剂为:浓硫酸;④定量实验应尽量精确,减小误差,实验中需要称量的是实验前后D装置的质量,如果空气中的CO2进入D装置会造成实验误差,影响实验的精确度,所以D装置后必须连接一个E装置。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目





 R-Br+H2O
R-Br+H2O