题目内容
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________。
(2)第一电离能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
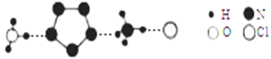
①R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________。
③图中虚线代表氢键,其表示式为(NH4+)NH…Cl、___________、____________。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
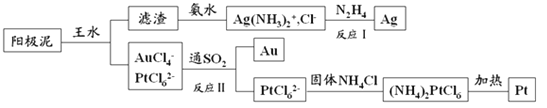
①滤渣的成分是_____________,(NH4)2PtCl6中配体是_______________________。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________,试写出该反应的化学方程式________。
【答案】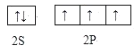 > N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能大 abd c 5
> N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能大 abd c 5 ![]() (H3O+)O-H…N (NH4+)N-H…N AgCl Cl- 王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水 Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O
(H3O+)O-H…N (NH4+)N-H…N AgCl Cl- 王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水 Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O
【解析】
(1)氮原子价层电子的电子排布式为2s22p3;
(2)N原子的2p轨道上有3个电子,为半充满结构,相对稳定;
(3)①根据图示,阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为![]() =0,价层电子对数为2,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为2,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;
=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;
②根据图示N5-中键总数为5个;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键;
(4)粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,过滤后的氯化银滤渣用氨水溶解氯化银变为银氨溶液,最后用N2H4将其还原为银,滤液中通入二氧化硫具有还原性,被氧化为硫酸,金的络离子被还原为金属金,过滤得到滤液中 含PtCl62-,加入固体氯化铵得到沉淀(NH4)2PtCl6,受热分解得到金属Pt。
(1)氮原子价层电子的电子排布式为2s22p3,则价层电子的轨道表达式为 ;
;
(2)N原子价层电子的电子排布式为2s22p3,而O原子价层电子的电子排布式为2s22p4,其中N原子的2p轨道为半充满状态,具有一定稳定性,故第一电离能N>O;
(3)①a.阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为![]() =0,价层电子对数为4,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为
=0,价层电子对数为4,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,价层电子对数为4,为sp3杂化;
=1,价层电子对数为4,为sp3杂化;
b.由以上分析可知H3O+和NH4+中心原子的价层电子对数都为4;
c.NH4+为空间构型为正四面体,H3O+为空间构型为三角锥形;
d.含有的共价键类型都为σ键;
则:两种阳离子的相同之处为abd,不同之处为c;
②根据图示N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号![]() 表示;
表示;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键,还可表示为(H3O+)O-H…N、(NH4+)N-H…N;
(4)①粗铜中含金、银、铁、镍、锌等杂质,电解时铜、铁、镍、锌被氧化,金、银、铂作为阳极泥而沉淀下来,王水溶解后得到金铂的溶液和AgCl沉淀,滤渣的成分是AgCl,(NH4)2PtCl6中配体是Cl-;
②金和浓硝酸反应,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡Au+6HNO3(浓)=Au(NO3)3+3NO/span>2↑+3H2O中Au3+浓度降低,平衡正移,金即可溶于王水;王水中硝酸的浓度降低,还原产物为NO,则生成H[AuCl4]时反应的化学方程式为Au + HNO3 + 4HCl ===H[AuCl4] + NO↑+ 2H2O。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25