题目内容
【题目】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是( )

A.b、d两点为恰好完全反应点
B.c点溶液中c(NH4+)=c(Cl-)
C.a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L
【答案】D
【解析】
A.b、d点溶液中![]() ,常温下
,常温下![]()
![]() ,所以
,所以![]() ,溶液呈中性,c点为氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,d点为盐酸和氯化铵的混合液,溶液显酸性,故A错误;
,溶液呈中性,c点为氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,d点为盐酸和氯化铵的混合液,溶液显酸性,故A错误;
B.根据图知,c点![]() ,
,![]() ,溶液呈酸性,结合电荷守恒得
,溶液呈酸性,结合电荷守恒得![]() ,故B错误;
,故B错误;
C.a、b之间的任意一点,溶液都呈碱性,即![]() ,结合电荷守恒得
,结合电荷守恒得![]() ,故C错误;
,故C错误;
D.常温下,![]() 的氨水溶液中
的氨水溶液中![]() ,则
,则![]() ,
,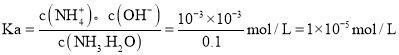 ,故D正确;
,故D正确;
故答案为D。

【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.由于Cu2+存在,IV中M的分解速率比I快
B.其它条件相同时,水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比II
D.在0~20 min内,I中M的平均分解速率为0.015mol/(L·min)