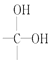
题目内容
【题目】能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
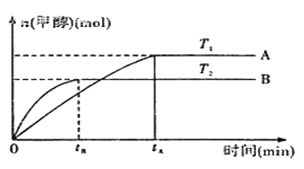
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
【答案】CH4 (g)+ 2O2(g)![]() CO2(g)+2H2O(l) △H=-890.31kJ/mol <
CO2(g)+2H2O(l) △H=-890.31kJ/mol < ![]() <
<
【解析】
(1)甲烷燃烧热是1mol甲烷燃烧生成二氧化碳和液态水放出的热量,依据热化学方程式书写方法标注聚集状态和对应焓变;(2) ①根据 “先拐先平”,可知T1<T2,升高温度后,甲醇的含量减小,平衡逆向移动;②根据平衡常数定义书写表达式;焓变<0,升高温,平衡逆向移动。
(1)甲烷燃烧热是1mol甲烷燃烧生成二氧化碳和液态水放出的热量,由题中信息可知,甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol;(2) ①根据 “先拐先平”,可知T1<T2,升高温度后,甲醇的含量减小,平衡逆向移动,所以合成甲醇反应的△H<0;②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)平衡常数的表达式为
CH3OH(g)+H2O(g)平衡常数的表达式为![]() ;T1<T2,焓变小于0,升高温,平衡逆向移动,K减小,所以T2时的平衡常数< T1时的平衡常数。
;T1<T2,焓变小于0,升高温,平衡逆向移动,K减小,所以T2时的平衡常数< T1时的平衡常数。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式____________.
(2)B元素在周期表中的位置____________;离子半径:B____________A(填“大于”或“小于”).原子半径:B____________C(填“大于”或“小于”).
(3)C原子的电子排布图是____________,其原子核外有____________个未成对电子,能量最高的电子为____________轨道上的电子,其轨道呈____________形.
(4)D﹣的结构示意图是____________.第一电离能D____________A(填“大于”或“小于”).
(5)C单质中的化学键为____________(填“极性键”或“非极性键”),1molC的气态氢化物中含有____________molσ键。