题目内容
【题目】在某温度时,将n molL-1氨水滴入10mL1.0 molL-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如右图所示,下列有关说法正确的是( )
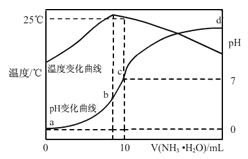
A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-)
D. 25℃时NH4Cl水解常数为(n-1)×10-7molL-1(用n表示)
【答案】D
【解析】试题分析:将n molL-1氨水滴入10mL1.0 molL-1盐酸中,发生反应:NH3·H2O+HCl==NH4Cl+H2O 。A、水的电离为吸热过程,升高温度促进电离,Kw增大,由图像知a点温度低于25℃,故Kw<1.0×10-14,错误;B、根据图像知b点溶液的温度最高,氨水和盐酸恰好完全反应,所得溶液为氯化铵溶液,水的电离程度最大,a点溶液为盐酸,抑制水的电离,d点溶液为氯化铵和氨水的混合物,抑制水的电离,d点pH未知,a、d两点温度不同,a、d两点水的电离程度无法比较,错误;C、根据图像知b点溶液的温度最高,氨水和盐酸恰好完全反应,所得溶液为氯化铵溶液,铵离子水解,离子浓度关系为C(Cl-) >C(NH4+) > C(H+) > C(OH-),错误;D、根据图像知25℃时溶液的pH=7,c(H+)=c(OH-)=1×10-7mol/L,结合电荷守恒知c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒知c(NH3·H2O)=0.5(n-1)mol/L,NH4Cl水解常数为Kh= c(H+) c(NH3·H2O)/ c(NH4+)=(n-1)×10-7molL-1,正确。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】用下图所示装置检验乙烯时不需要除杂的是 ( )
乙烯的制备 | 试剂X | 试剂Y |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓H2SO4加热至170℃ | 资*源%库NaOH溶液 | KMnO4酸性溶液 | |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D