题目内容
下列说法正确的是
| A.Na2O2可作为潜艇工作人员的供氧剂 |
| B.常温下铝箔放在浓HNO3中,生成H2 |
| C.水蒸气通过炽热的铁,生成Fe(OH)3和H2 |
| D.用新制Cu(OH)2检查尿糖,Cu(OH)2是还原剂 |
A
解析试题分析:过氧化钠与二氧化碳或水容易反应,生成氧气,故A选项正确;常温下浓硝酸能使铝钝化,单质铝表面产生一层保护膜,阻止内层的单质铝与浓硝酸的反应,且因为硝酸是氧化性酸,硝酸根离子的氧化性远远大于氢离子,前者优先被还原为NO2气体,不可能产生氢气,故B选项错误;氢氧化铁是难溶性碱,高温下易分解为铁的氧化物和水,因此水蒸气通过炽热的铁时,不可能生成氢氧化铁,而是生成四氧化三铁和氢气,即3Fe+4H2O(g)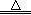 Fe3O4+4H2, 故C选项错误;用新制氢氧化铜检查尿糖时,氢氧化铜变为氧化亚铜,铜元素由+2降为+1价,得到电子,被还原,则氢氧化铜是氧化剂,而葡萄糖是还原剂,发生氧化反应,故D选项错误。
Fe3O4+4H2, 故C选项错误;用新制氢氧化铜检查尿糖时,氢氧化铜变为氧化亚铜,铜元素由+2降为+1价,得到电子,被还原,则氢氧化铜是氧化剂,而葡萄糖是还原剂,发生氧化反应,故D选项错误。
考点:考查常见元素及其化合物的性质和应用,主要涉及过氧化钠的用途、铝的钝化、浓硝酸的氢氧化性及其还原产物、水蒸气与炽热铁反应的产物、葡萄糖与新制氢氧化铜反应时的氧化剂与还原剂等。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列推断正确的是
| A.Cl2,SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B.因为氨水是弱碱,所以不能用FeCl3溶液和氨水反应制取Fe(OH)3 |
| C.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用它来净水 |
| D.浓硫酸为强氧化剂,二氧化硫为强还原剂,所以不能用前者干燥后者 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 在Ba(NO3)2溶液中分别滴入H2SO3及H2SO4溶液 | 均有白色沉淀 | 沉淀均为BaSO4 |
| B | 混合装有Cl2和NH3量集气瓶中的气体 | 产生大量白烟 | NH3显还原性和碱性 |
| C | 溶液X中滴入盐酸酸化的FeCl2溶液,再滴入淀粉溶液 | 溶液变蓝色 | 溶液X中一定含有I- |
| D | 向浓度居委0.01mol/LNaCl和Na2S的混合溶液中滴入少量AgNO3 | 出现黑色沉淀 | Ksp(Ag2S)>Ksp(AgCl) |
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
下列有关物质的性质或应用不正确的是( )
| A.在使用纯碱溶液清洗油污时,加热可以增强其去污能力 |
| B.液氨汽化时要吸收大量的热,因此氨常做制冷剂 |
| C.向AlCl3溶液中加入过量氢氧化钠溶液,制备氢氧化铝 |
| D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用醋酸除去 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥NH3 |
| B | SO2有漂白性 | SO2可使溴水的橙色褪去 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
下列关于甲、乙、丙、丁四个图像的说法中,不正确的是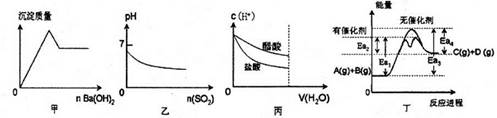
| A.甲是向KAl(S04)2溶液滴加Ba(0H)2时,沉淀质量与Ba(OH)2物质的量的关系图 |
| B.乙是向溴水通入S02气体时,pH与S02物质的量的关系图 |
| C.丙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
D.由丁可知,A与B在有催化剂存在的热化学方程式为: 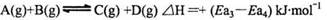 |
