题目内容
11.ag镁铝合金投入x mL 2mol/L的盐酸中,金属完全溶解,再加入y mL1mol/L的NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是( )| A. | 镁铝合金与盐酸反应转移电子数为0.1NA | |
| B. | 产生的H2在标况下体积为1.12L | |
| C. | x一定等于50 | |
| D. | a的取值范围为0.9<a<1.2 |
分析 向Mg、Al合金与盐酸反应后的反应中加入NaOH溶液沉淀达到最大值,沉淀是Mg (OH)2和Al(OH)3的混合物,此时溶液中溶质为NaCl,
A.沉淀混合物含有的OH-的质量为1.7g,镁铝合金提供的电子等于混合物中OH-所带的电量;
B.根据电子转移守恒计算生成氢气的物质的量,再结合V=nVm计算;
C.反应中盐酸可能过量,则x可能大于50ML;
D.利用极限法解答,当全为Al时,a有极小值,当全为Mg时,a有极大值,根据电子转移守恒计算金属的物质的量,再根据m=nM计算.
解答 解:向Mg、Al合金与盐酸反应后的反应中加入NaOH溶液沉淀达到最大值,沉淀是Mg (OH)2和Al(OH)3的混合物,此时溶液中溶质为NaCl,
A.沉淀混合物含有的OH-的质量为(a+1.7)g-ag=1.7g,物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,镁铝合金提供的电子等于混合物中OH-所带的电量,镁铝合金与盐酸反应转移电子总数为0.1mol×NAmol-1=0.lNA,故A正确;
B.由A分析可知,金属提供电子为0.1mol,根据电子转移守恒可知,生成氢气的物质的量为$\frac{0.1mol}{2}$=0.05mol,标准状况下氢气的体积为0.05mol×22.4L/mol=1.12L,故B正确;
C.当盐酸与金属恰好反应时,根据氢元素守恒可知HCl的物质的量为0.05mol×2=0.1mol,氯化氢的体积为$\frac{0.1mol}{2mol/L}$=0.05L=50mL,而盐酸可能过量,则x≥50mL,故C错误;
D.当完全为Al时,Al的物质的量为$\frac{0.1mol}{3}$,故a的极小值为为$\frac{0.1mol}{3}$×27g/mol=0.9g,当全为Mg时,Mg的物质的量为0.05mol,a的极大值=0.05mol×24g/mol=1.2g,故a的取值范围为0.9g<a<1.2g,故D正确;
故选C.
点评 本题考查混合物反应的计算、镁铝及其化合物的性质,题目难度中等,确定沉淀中含有OH-的质量是解题关键,注意利用守恒进行计算,试题充分考查了学生的分析能力及化学计算能力.


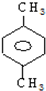
| A. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3 | |
| C. | 若A的分子式为C3H6O2,则其结构简式为CH3COOCH3 | |
| D. | 若A的化学式为C3H6O2,则其可能的结构有三种 |
| A. | 转移电子为1.0mol | B. | W可能等于48.8 | ||
| C. | V可能等于360 | D. | 发生的反应均为氧化还原反应 |
 )的说法中正确的是( )
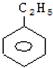
)的说法中正确的是( )| A. | 分子组成符合通式CnH2n+2 | |
| B. | 分子中含有3个C-C键和3个C=C键 | |
| C. | 在空气中燃烧时产生较多的黑烟 | |
| D. | 苯中加入溴水后溴水层颜色变浅,这是发生了加成反应 |