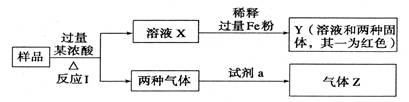
题目内容
下列有关元素化合物的叙述中正确的是
| A.钠在空气中燃烧生成白色的氧化钠固体 |
| B.检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 |
| C.二氧化硫的水溶液能使紫色石蕊溶液变红,但不能使之褪色 |
| D.普通玻璃的组成可用Na2O·CaO·6SiO2表示,是纯净物 |
BC
解析试题分析:A.钠在空气中燃烧成过氧化钠,是淡黄色,错误;B.利用Fe3++3SCN-=Fe(SCN)3,生成的Fe(SCN)3显血红色,而Fe2+则没有这样的性质,正确;C.二氧化硫溶于水生成亚硫酸使石蕊试液变红,但不能使其褪色,正确;D.普通玻璃的成分是硅酸三钙、硅酸二钙、铝酸三钙,是混合物,错误。
考点: 考查了钠、铁、硫、硅及其化合物的性质;离子检验的方法。

 阅读快车系列答案
阅读快车系列答案为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)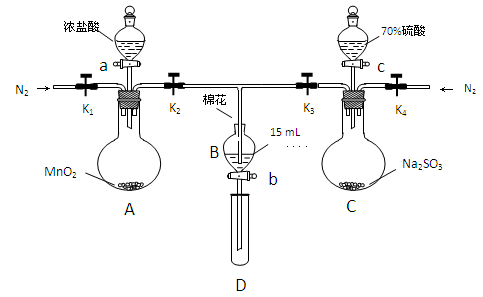
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq)
 FeSO3(s)
FeSO3(s)提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色。
某同学设计如下实验,正式该假设的成立:
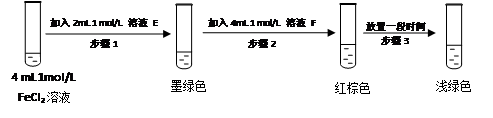
溶液E和F分别是___________、_______________
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因___________________________
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.合金的熔点一般比组分金属低 |
| B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
在一定量的Fe、FeO、Fe2O3的混合物中,加入100mL、1.1mol/L的盐酸反应并放出标准状况下224mL气体,反应后溶液中阳离子只有Fe2+、H+,且溶液的pH=1(不考虑盐的水解及溶液体积的变化)。则反应后溶液Fe2+的物质的量浓度(mol·L-1)为
| A.0.05 | B.0.5 | C.0.55 | D.1.1 |
已知在酸性条件下能发生下列反应:Cu+→ Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol·L-1硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是二氧化硫 | D.反应中硫酸作氧化剂 |
碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是( )
| A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间 |
| B.“侯氏制碱法”制得的碱是指NaHCO3 |
| C.可用盐酸鉴别Na2CO3和NaHCO3固体 |
| D.纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
将0.1mol镁铝合金(Mg17Al12)完全溶解于1.2 L 6mol/L的盐酸中,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10 mol/L的氨水至少
| A.0.56L | B.0.70 L | C.0.72L | D.0.84 L |