题目内容
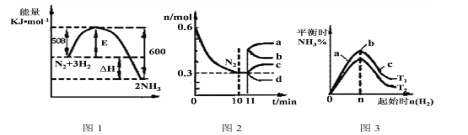
【题目】根据图中的信息得出的结论正确的是
A. 2C(s)+O2(g) ═ 2CO(g) ΔH=-110.0 kJ/mol
B. C(s)+O2(g) ═ CO2(g) ΔH=393.5 kJ/mol
C. CO(g)+1/2O2(g) ═ CO2(g) ΔH=-283.0 kJ/mol
D. 36 g碳完全燃烧放出220.0 kJ热量
【答案】C
【解析】
A.据图示可知,1molC燃烧生成CO放热393.5kJ-283.0kJ=110.5kJ,所以2molC燃烧生成CO放热221.0kJ,A项错误;
B. C(s)+O2(g) ═ CO2(g) ΔH=393.5 kJ/mol中反应热为放热,符号为“-”,B项错误
C.1molCO燃烧生成1mol二氧化碳放热283kJ,所以CO(g)+1/2O2(g) ═ CO2(g) ΔH=-283.0 kJ/mol,C项正确;
D. 36 g碳应为3molC,完全燃烧生成二氧化碳放热为393.5kJ×3=1180.5kJ,D项错误;
答案选C。

练习册系列答案
相关题目