题目内容
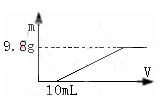
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5 mol·L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为
- A.0.05mol
- B.0.1mol
- C.0.2mol
- D.0.25mol
D
试题分析:铜与稀硝酸反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.由于硝酸过量,加入的氢氧化钠溶液首先和过量的硝酸反应生成硝酸钠,然后再与硝酸铜溶液反应产生氢氧化铜沉淀。反应后的溶液为硝酸铜和硝酸钠混合液。与硝酸反应消耗的氢氧化钠为10ml,所以硝酸钠中硝酸根离子为:n((NO3-)=n(Na+)="0.01×5" mol∕L="0.05" mol.n(Cu)=m∕M=6.4g∕64(g∕mol)=0.1mol. n{Cu(NO3)2}=0.1mol,硝酸铜中的硝酸根离子的物质的量为:=0.1mol×2=0.2mol.n((NO3-)总="0.2mol+0.05" mol="0.25" mol。选项为:D。
考点:考查 硝酸的化学性质及溶液中离子的物质的量的应该计算的知识。
试题分析:铜与稀硝酸反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.由于硝酸过量,加入的氢氧化钠溶液首先和过量的硝酸反应生成硝酸钠,然后再与硝酸铜溶液反应产生氢氧化铜沉淀。反应后的溶液为硝酸铜和硝酸钠混合液。与硝酸反应消耗的氢氧化钠为10ml,所以硝酸钠中硝酸根离子为:n((NO3-)=n(Na+)="0.01×5" mol∕L="0.05" mol.n(Cu)=m∕M=6.4g∕64(g∕mol)=0.1mol. n{Cu(NO3)2}=0.1mol,硝酸铜中的硝酸根离子的物质的量为:=0.1mol×2=0.2mol.n((NO3-)总="0.2mol+0.05" mol="0.25" mol。选项为:D。
考点:考查 硝酸的化学性质及溶液中离子的物质的量的应该计算的知识。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
