题目内容
某溶液中含有Ba2+、HCO3-、Cl-、NO3-四种离子,先向溶液中加入足量NaOH,再加入足量稀盐酸,溶液中大量减少的是( )
| A、Ba2+ | B、HCO3- | C、Cl- | D、NO3- |
分析:依据离子反应和离子性质分析判断,先向溶液中加入足量NaOH,反应的离子为HCO3-,再加入足量稀盐酸也是和HCO3-反应,其他两种不发生反应;
解答:解:某溶液中含有Ba2+、HCO3-、Cl-、NO3-四种离子,先向溶液中加入足量NaOH,能发生反应的离子使HCO3-+OH-=H2O+CO32-,再加入足量稀盐酸,发生的反应为OH-+H+=H2O,分析过程可知减少最大的离子为HCO3-;
故选B.
故选B.
点评:本题考查了离子性质和离子反应的分析判断,掌握离子性质是解题关键,题目较简单.

练习册系列答案
相关题目
 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)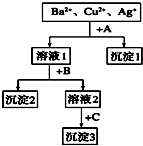 某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程如图(写出最佳答案).
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程如图(写出最佳答案).