题目内容
| |||||||||||||||||||||||||||
解析:
(1) |
③①④② |
(2) |
MnO2+4H++2Cl- |
(3) |
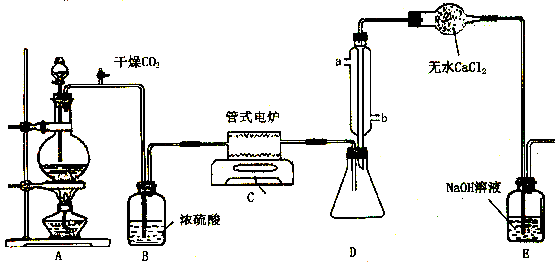
排尽装置内的空气,避免TiCl4遇空气中水蒸气发生水解 |
(4) |
b,吸收多余的Cl2,以免污染空气 |
(5) |
TiCl4+4H2O==4HCl+Ti(OH)4 |
(6) |
防止Mg和Ti被空气中氧气氧化 |

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案|
工业上常用金属钠来提炼钛、锆等.已知在700℃-800℃时,钠可从四氯化钛(TiCl4)中还原出钛,则用此法制取96 g钛时需要钠的理论质量为 | |
| [ ] | |
A. |
11.5 g |
B. |
23 g |
C. |
184 g |
D. |
92 g |
| |||||||||||||||||||||||


 Fe3++3H2O的平衡常数K=
。
Fe3++3H2O的平衡常数K=
。