题目内容
【题目】化学与生产、生活密切相关。下列说法错误的是
A.可利用电渗析法淡化海水
B.硅胶常用作催化剂的载体和干燥剂
C.冬奥会速滑服所用的材料聚氨酯属于新型无机非金属材料
D.75%的酒精、高温、紫外线能够杀灭新型冠状病毒的原因都是使蛋白质变性
【答案】C
【解析】
A.海水淡化的方法有蒸馏法、离子交换法、电渗析法等,故A正确;
B.硅胶具有较强的吸附性,可用于催化剂载体或干燥剂,故B正确;
C.聚氨酯为聚氨基甲酸酯,是有机高分子合成材料,故C错误;
D.75%的酒精、高温、紫外线能够使蛋白质变性,故能杀灭新型冠状病毒,故D正确。
答案选C。

【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
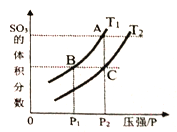
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
