题目内容
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
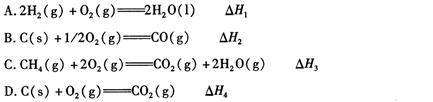

(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。

(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
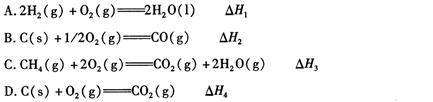

(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。

(1)DE (2)KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l) △H6.
或H+( aq)+OH-(aq)=H2O(l)(3)环形玻璃搅拌棒 偏小。
或H+( aq)+OH-(aq)=H2O(l)(3)环形玻璃搅拌棒 偏小。
试题分析:物质的燃烧热指1mol物质充分燃烧,生成稳定氧化物时放出的热量;而中和热指稀的强酸与强碱反应生成1mol水时放出的热量;中和热的测定过程中注意装置的隔热效果要好,而且要不断搅拌。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1,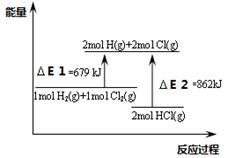
 O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol