题目内容
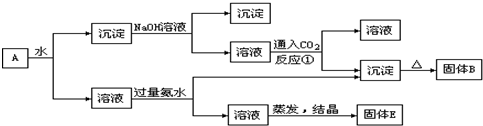
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的转化关系.用方程式表示①、②、③、④四个反应时,其中错误的是( )

分析:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,故E为K2SO4 和(NH4)2SO4.
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,故E为K2SO4 和(NH4)2SO4.
解答:解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,故E为K2SO4 和(NH4)2SO4;
A、由上述分析可知,反应①是Al2O3与NaOH溶液反应生成NaAlO2,方程式为Al2O3+2NaOH═2NaAlO2+H2O,故A正确;
B、由上述分析可知,反应②是铝离子与过量氨水反应生成氢氧化铝沉淀,方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B正确;
C、由上述分析可知,反应③是AlO2-在弱酸性条件下生成氢氧化铝沉淀,反应方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓(CO2过量),故C错误;
D、由上述分析可知,反应④是Al(OH)3受热分解生成氧化铝与水,方程式为2Al(OH)3
Al2O3+3H2O,故D正确;
故选C.
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,故E为K2SO4 和(NH4)2SO4;
A、由上述分析可知,反应①是Al2O3与NaOH溶液反应生成NaAlO2,方程式为Al2O3+2NaOH═2NaAlO2+H2O,故A正确;
B、由上述分析可知,反应②是铝离子与过量氨水反应生成氢氧化铝沉淀,方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B正确;
C、由上述分析可知,反应③是AlO2-在弱酸性条件下生成氢氧化铝沉淀,反应方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓(CO2过量),故C错误;
D、由上述分析可知,反应④是Al(OH)3受热分解生成氧化铝与水,方程式为2Al(OH)3
| ||
故选C.
点评:本题以框图形式考查物质的性质、化学用语书写等,具有一定的综合性,本题的关键在于Al2O3具有两性,难度中等.

练习册系列答案
相关题目