题目内容
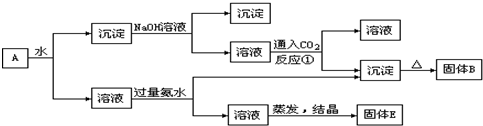
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出B、D所含物质的化学式.固体B ;沉淀D .
(3)试剂③是 (填化学式)
(4)写出①的化学反应方程式 ;②的离子反应方程式 .

据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出B、D所含物质的化学式.固体B
(3)试剂③是
(4)写出①的化学反应方程式
分析:由流程可知,Al2O3和Fe2O3不溶于水,则沉淀C为Al2O3和Fe2O3,氧化铁与碱不反应,则沉淀D为Fe2O3,反应②③中生成的沉淀为Al(OH)3,氢氧化铝受热分解生成氧化铝,则B为Al2O3,反应②为KAl(SO4)2、氨水的反应,则溶液E为K2SO4、(NH4)2SO4、NH3.H2O,然后结合物质的性质分析解答.
解答:解:由流程可知,Al2O3和Fe2O3不溶于水,则沉淀C为Al2O3和Fe2O3,氧化铁与碱不反应,则沉淀D为Fe2O3,反应②③中生成的沉淀为Al(OH)3,氢氧化铝受热分解生成氧化铝,则B为Al2O3,反应②为KAl(SO4)2、氨水的反应,则溶液E为K2SO4、(NH4)2SO4、NH3.H2O,
(1)分离不溶性固体和溶液的方法为过滤,所以Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离方法为过滤,故答案为:过滤;
(2)由上述分析可知,B为Al2O3,D为Fe2O3,故答案为:Al2O3;Fe2O3;
(3)偏铝酸钠和适量强酸或二氧化碳反应都生成氢氧化铝沉淀,所以试剂③是HCl、HNO3、H2SO4、CO2中的一种即可,故答案为:HCl、HNO3、H2SO4、CO2中的一种;
(4)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
硫酸铝钾和氨水反应生成氢氧化铝沉淀和硫酸铵,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
(1)分离不溶性固体和溶液的方法为过滤,所以Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离方法为过滤,故答案为:过滤;
(2)由上述分析可知,B为Al2O3,D为Fe2O3,故答案为:Al2O3;Fe2O3;
(3)偏铝酸钠和适量强酸或二氧化碳反应都生成氢氧化铝沉淀,所以试剂③是HCl、HNO3、H2SO4、CO2中的一种即可,故答案为:HCl、HNO3、H2SO4、CO2中的一种;
(4)氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
硫酸铝钾和氨水反应生成氢氧化铝沉淀和硫酸铵,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
点评:本题考查了物质的分离和提纯,明确物质的性质是解本题关键,知道氧化铝、氢氧化铝的特殊性即可解答,根据氢氧化铝的特性确定实验室制取氢氧化铝的方法,难度中等.

练习册系列答案
相关题目