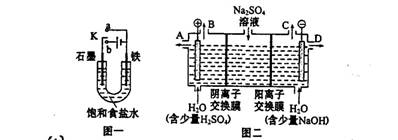
题目内容
|
已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol.现有H2和CO组成的混合气体56.0 L(标准状况),经充分燃烧后,放出的总热量为710.0 kJ,并生成液态水.下列说法正确的是 | |
| [ ] | |
A. |
CO燃烧的热化学方程式为:2CO(g)+O2(g) |
B. |
H2燃烧的热化学方程式为:2H2(g)+O2(g) |
C. |
燃烧前混合气体中,H2的体积分数为40% |
D. |
燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol |
答案:C

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
已知H2的燃烧热为-285.8kJ/mol,CO的燃烧热为-282.8kJ/mol.现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出的总热量为710.0kJ,并生成液态水.下列说法正确的是( )
| A、CO燃烧的热化学方程式为:2CO(g)+O2(g)═2CO2(g)△H=+282.8 kJ/mol | B、H2燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | C、燃烧前混合气体中,H2的体积分数为40% | D、燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol |