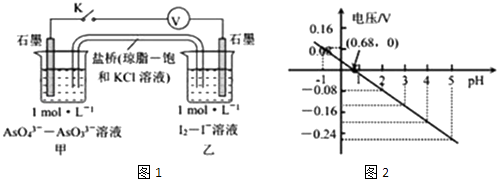
题目内容
【题目】某强酸性溶液X,含有Fe3+、Fe2+、Ba2+、Al3+、NH4+、CO32﹣、SiO32﹣、SO42﹣、NO3﹣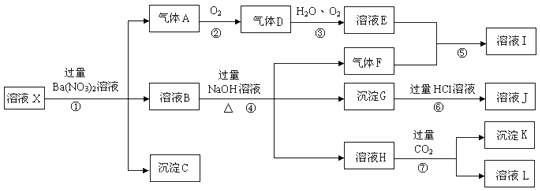
依据以上信息,回答下列问题:
(1)写出步骤①生成气体A的离子方程式 .
(2)气体F的电子式为 , 实验中,可以观察到反应②的现象是: .
(3)检验溶液I中存在的阳离子的方法是 .
(4)沉淀G的化学式为;写出反应⑦的化学方程式 .
(5)溶液X中肯定存在的离子有 , 可能存在的离子有 .
【答案】
(1)3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O
(2)![]() ;无色气体变为红棕色
;无色气体变为红棕色
(3)取样,加碱(NaOH)溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
(4)Fe(OH)3;NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3
(5)Fe2+、Al3+、NH4+、SO42﹣;Fe3+
【解析】解:(1)产生气体A的离子方程式为3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O,所以答案是:3Fe2++NO3﹣+4H+=3Fe3++NO+2H2O;(2)F是NH3 , 电子式为 ![]() ,气体A是NO,为无色气体,与氧气反应生成红棕色的NO2 , 所以答案是:
,气体A是NO,为无色气体,与氧气反应生成红棕色的NO2 , 所以答案是: ![]() ;无色气体变为红棕色;(3)溶液Ⅰ中的含有的阳离子是铵根离子,铵根离子的检验方法是:取样,加碱(NaOH)溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,所以答案是:取样,加碱(NaOH)溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;(4)由以上分析可知沉淀G是Fe(OH)3 , 溶液H中含有偏铝酸根,通入二氧化碳生成沉淀K是Al(OH)3 , 方程式为NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3 , 所以答案是:Fe(OH)3;NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;(5)由以上分析可知肯定存在的离子为Fe2+、Al3+、NH4+、SO42﹣ , 可能存在的离子为Fe3+ , 所以答案是:Fe2+、Al3+、NH4+、SO42﹣;Fe3+ .
;无色气体变为红棕色;(3)溶液Ⅰ中的含有的阳离子是铵根离子,铵根离子的检验方法是:取样,加碱(NaOH)溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,所以答案是:取样,加碱(NaOH)溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;(4)由以上分析可知沉淀G是Fe(OH)3 , 溶液H中含有偏铝酸根,通入二氧化碳生成沉淀K是Al(OH)3 , 方程式为NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3 , 所以答案是:Fe(OH)3;NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;(5)由以上分析可知肯定存在的离子为Fe2+、Al3+、NH4+、SO42﹣ , 可能存在的离子为Fe3+ , 所以答案是:Fe2+、Al3+、NH4+、SO42﹣;Fe3+ .