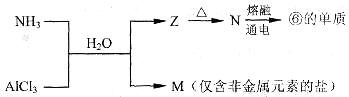
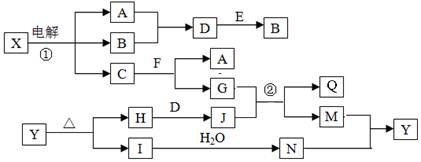
题目内容
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: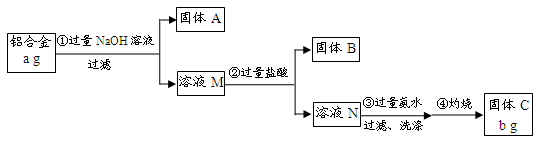
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
(1)Mg、Cu
(2)SiO32-+2H+=H2SiO3↓ Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+
(3)取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净。
(4)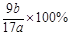 (5)C D (每空2分)
(5)C D (每空2分)
解析试题分析:⑴根据铝合金的主要成分为铝、镁、铜、硅,只有铝、硅与过量NaOH溶液反应溶解,则过滤所得固体A的成分是Mg、Cu;
⑵溶液M中主要含有NaAlO2、Na2SiO3,加入过量盐酸,Na2SiO3与盐酸反应生成H2SiO3沉淀(固体B);溶液N中主要含有AlCl3,步骤③加入过量氨水与其反应生成Al(OH)3沉淀;
⑶步骤③洗涤沉淀表面上的可溶性杂质NaCl、NH4Cl;用AgNO3溶液可检验沉淀是否洗涤干净;
⑷据题意知固体C为Al2O3,据铝原子守恒可计算出样品中铝的质量分数=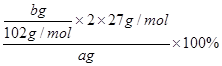 =
=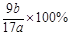 ;
;
⑸A项第①步中加入NaOH溶液不足,铝不能全部溶解,会导致结果偏小;B项第②步中加入盐酸不足时,氢氧化铝不能完全溶解,会导致结果偏小;C项第③步中沉淀未用蒸馏水洗涤会导致氧化铝含有杂质,其质量偏大,会使测定结果偏大;D项第④步对沉淀灼烧不充分,会导致氧化铝中含有氢氧化铝,将导致铝的含量偏大,综上分析可确定C、D项正确。
考点:考查化工流程图。

下列叙述正确的是
| A.将FeCl3溶液加热蒸干得到FeCl3固体 |
| B.向Fe(NO3)2溶液中加少量盐酸,无明显现象 |
| C.向氢氧化镁悬浊液中滴加FeCl3溶液,无明显现象 |
| D.向FeSO4溶液中滴加NaOH溶液,先出现白色沉淀,最终沉淀转化成红褐色 |
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。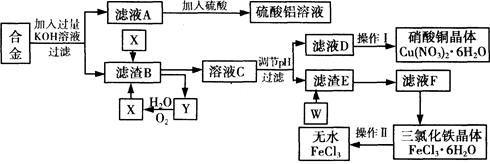
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
(6)写出滤渣E与W反应的化学方程式: 。
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):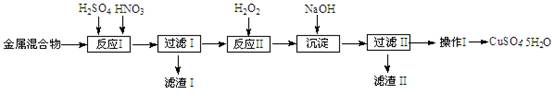
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O
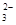 = 2Iˉ+S4O
= 2Iˉ+S4O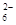
求样品中胆矾晶体的质量分数(写出计算过程)。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: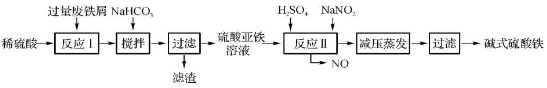
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的____(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定