题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的是
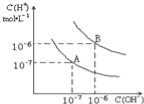
A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L
B.15℃时,pH=7的溶液呈酸性
C.AB连线上的点均表示中性溶液
D.B点对应的温度高于A点对应的温度
【答案】A
【解析】
试题分析:水的电离为吸热过程,温度升高,电离程度增大,c(H+)、c(OH-)浓度增大,Kw增大。由图像可知,A点为25℃的电离平衡曲线,此温度下Kw=1×10-14,B点为95℃的电离平衡曲线,此温度下的Kw=1×10-12。A.95℃时,pH=4的H2SO4溶液中,c(H+)=1×10-4mol/L,则由水电离出的c(OH-)=1×10-8mol/L,故A错误;B.15℃时,Kw<1×10-14,则中性水的pH>7,pH=7的溶液呈酸性,故B正确;C.AB连线上的点均有c(H+)=c(OH-),表示溶液呈中性,故C正确;D.B点对应的温度为95℃,A点对应的温度为25℃,故D正确;故选A。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目