��Ŀ����
��12�֣�I��һ���¶���,���ݻ�ΪV L���ܱ������н��з�Ӧ��aN��g�� bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��

��1���˷�Ӧ�Ļ�ѧ����ʽ�� =__________
=__________
��2��t1��t2ʱ��,��M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��____________
��3��ƽ��ʱ��N��ת����Ϊ ��
��4��������������˵��������Ӧ�ﵽƽ��״̬����
A����Ӧ��M��N�����ʵ���֮��Ϊ1�U1
B��������������������ʱ��ı仯���仯
C���������������ʵ�������ʱ��ı仯���仯
D����λʱ����ÿ����a mol N��ͬʱ����b mol M
E����������ѹǿ����ʱ��ı仯���仯
F��N�����������ڻ�������б��ֲ���
II����1�����������ǿ����������ɫ��Դ����֪��������ֵ��143kJ��g-1����ȼ��1molH2�ų�������Ϊ kJ��
��2��1molN2(g)��1molO2��g����һ�������·�Ӧ����2molNO(g)������180kJ����������֪����1molN2(g)�е�N��N��1molO2��g���е�O=O�ֱ���Ҫ����946kJ��498kJ����������1molNO�����еĻ�ѧ���γ�ʱ���ͷ�_______kJ��������
I����1��2��2��1/(t2-t1)V mol��(L��min)-1 ��3��75% ��4��CEF zxxk
II����1��286 ��2��632
��������I����1������ͼ���֪��Ӧ���е�t1ʱN������8mol��6mol��2mol��M������3mol��2mol��1mol�����ݱ仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪a�Ub��2�U1��
��2��t1��t2ʱ��M�����ʵ���������4mol��3mol��1mol����Ӧ����ͨ���õ�λʱ����Ũ�ȵı仯������ʾ�������M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ ��
��
��3��ƽ��ʱN�����ʵ���������8mol��2mol��6mol��������ת������ ��
��
��4��M��N�����ʵ���֮��Ϊ1�U1�����ܵó����淴Ӧ�����Ƿ���ȣ�A����˵�������������غ㶨�ɿ�֪������ʼ���Dz���ģ�B����˵������Ϊ��Ӧ�������С�ķ�Ӧ�������ڷ�Ӧ��������������ʵ�����ѹǿ�DZ仯�ģ�ֱ���ﵽƽ��Ų��ٱ仯��C��E����˵����ѡ��D�е����ʷ�������ͬ�ģ���˲���˵����ѡ��F���ڻ�ѧƽ��״̬������������˵����
II����1��1molH2��2g�����Էų���������143kJ��g-1��2g��286kJ��
��2����Ӧ�ȵ��ڶϼ������յ������ͳɼ����ų��������IJ�ֵ����946kJ��498kJ��2��x��180kJ�����x��632kJ��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
��1����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) ��H=��92.4kJ/mol
2NH3(g) ��H=��92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ/mo
����17g��������������ȫ����һ�����������ˮ�������ų�������Ϊ ��
��2��ij����С���о����������������������£��ı���ʼ�����������ʵ�����N2(g)+3H2(g) ![]()
2NH3(g)��Ӧ��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����

��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 T2������ڡ������ڡ������ڡ�����ȷ������
�ڱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ��� ������ĸ����
������ʼ��ϵ�м���N2�����ʵ���Ϊ molʱ����Ӧ�İٷֺ�������������ݻ�ΪH��n=3mol��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������£�T2������Ӧ��ƽ�ⳣ��K= ��
��3��N2O3��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��
��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
2N2O3![]() 4NO2(g)+O2 ��H>0�±�Ϊ��Ӧ��T1�¶��µIJ���ʵ������
4NO2(g)+O2 ��H>0�±�Ϊ��Ӧ��T1�¶��µIJ���ʵ������
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol��L��1 | 5.00 | 3.52 | 2.48 |
��500s��NO2��ƽ����������Ϊ .
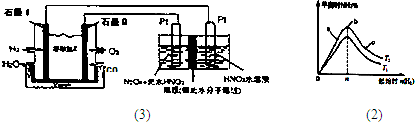
������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O3��װ����ͼ��ʾ������YΪCO2��

д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ ��
�ڵ���������N2O3�ĵ缫��ӦʽΪ ��
��14�֣��о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
�� ��һ��������ܱ������У����л�ѧ��Ӧ�� CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
�ٸ÷�Ӧ����Ӧ�� ��Ӧ��������ȡ������ȡ���
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ��
| A������ѹǿ���� | B�����������c(CO2)���� | C������(H2)������(H2O) | D��c(CO2)��c(CO) |
�ƹ�ҵ�Ϻϳɼ״������ܱ������в������·�Ӧ���У�
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ��H����49.0 kJ��mol��1
CH3OH(g) +H2O(g) ��H����49.0 kJ��mol��1 �ٸ÷�Ӧ��ƽ�ⳣ������ʽK�� ��
��ijʵ�齫1molCO2��3molH2����һ��������ܱ������У������ֲ�ͬ�����·�����Ӧ��ֻ��һ��������ͬ�������CH3OH�����ʵ�����ʱ��仯��ͼ��ʾ��

����I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K����ѡ���������������������
��һ���¶��£����ݻ�2L�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
Ҫʹƽ��������������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���c��ȡֵ��ΧΪ ��

 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮