题目内容
下列图示与对应的叙述相符的是

A.图I表示向1L浓度均为0.1 mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液,产生沉淀量的变化
B.图Ⅱ中逆反应的热效应△H=E1- E2 <0,所以逆反应为放热反应
C.图Ⅲ表示向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,溶液pH的变化,c点溶液中:c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+)
D.用0.1 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图Ⅳ曲线可确定HX的酸性最强
C
【解析】
试题分析:A.首先发生反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,然后发生反应:H++ AlO2-+H2O=Al(OH)3↓; Al(OH)3+3H+=Al3++ 3H2O.错误。B.图Ⅱ中正反应的热效应△H=E1- E2 <0,所以逆反应为放热反应。错误。C. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+使溶液显碱性,当向溶液中加入HCl时发生反应:CO32一+H+= HCO3一;随着HCl的不断滴入,继续发生反应HCO3一+H+= H2CO3。根据电荷守恒可得c(HCO3一)+2c(CO32一)+c(C1-)+c(OH-)=c(Na+)+c(H+).C点的溶液为酸性溶液。c(H+)>c(OH-),所以c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+)。正确。D. 由滴定曲线图可以看出: 三种一元酸的浓度相同,但是c(H+)不同,HZ的pH最小,说明HZ的酸性最强;HX的pH最大,则HX酸性最弱。错误。
考点:考查图像法在中和反应、沉淀反应、离子浓度的大小比较溶液酸碱性强弱的比较中的应用的知识。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案A、图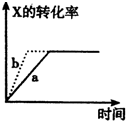 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | B、图 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 | C、图 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 | D、图 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |


