题目内容
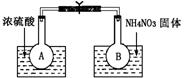
已知2NO2(g)?N2O4(g),在体积都为V的A和B两个密闭玻璃容器中,分别注入容积颜色相同的NO2和Br2(气),然后将两个容器体积同时扩大为2V,过一会儿可以看到( )
分析:由于存在2NO2?N2O4平衡,将两个容器体积同时扩大为2V,容器体积增大,压强减小,平衡向着逆向移动,二氧化氮含量增加,颜色比溴蒸汽深,
由于体积增大,A、B中的颜色都会变浅,据此进行判断.
由于体积增大,A、B中的颜色都会变浅,据此进行判断.
解答:解:A中存在2NO2?N2O4平衡,将两个容器体积同时扩大为2V,浓度均减小,则A、B中的颜色都会变浅,
但A容器体积增大,压强减小,平衡向着逆向移动,二氧化氮含量增加,A中颜色比B中溴蒸汽深,
故选B.
但A容器体积增大,压强减小,平衡向着逆向移动,二氧化氮含量增加,A中颜色比B中溴蒸汽深,
故选B.
点评:本题考查了压强对化学平衡的影响,根据平衡移动原理进行分析即可,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
 N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1。