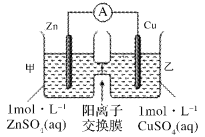
题目内容
【题目】![]() 、
、![]() 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:
(1)常温时,![]()
![]() 溶液的
溶液的![]() 。
。
则溶液中![]() ______c
______c![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;![]() ______
______![]() 填数值
填数值![]() 。
。
(2)![]() 时,
时,![]()
![]() 溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________
溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________![]() 用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答![]() 。
。
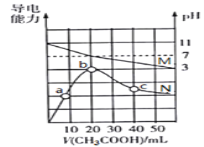
(3)常温时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向![]() 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。

(4)浓度均为![]() 溶液和
溶液和![]() 溶液,其中______溶液
溶液,其中______溶液![]() 大。
大。
【答案】![]()
![]() 或
或![]()
![]() 、
、![]() 存在水解平衡:
存在水解平衡:![]() 、
、![]() ,升高促进水解,
,升高促进水解,![]() 增大,pH减小
增大,pH减小 ![]()
![]()
【解析】
(1)本题考查物料守恒和电荷守恒,根据物料守恒,以及NH4Al(SO4)2,推出c(NH4+)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3],根据电荷守恒,c(NH4+)+3c(Al3+)+c(H+)=c(OH-)+2c((SO42-);
(2)本题考查影响盐类水解的因素,NH4Al(SO4)2溶液显酸性,是因为存在NH4++H2O![]() NH3·H2O+H+、Al3++3H2O
NH3·H2O+H+、Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(3)本题考查滴定实验,NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-;
(4)本题考查影响盐类水解的因素,Al3+、H+都抑制NH4+的水解,H+抑制NH4+水解能力强。
(1)根据物料守恒,以及NH4Al(SO4)2,推出c(NH4+)+c(NH3·H2O)=c(Al3+)+c[Al(OH)3],根据电荷守恒,c(NH4+)+3c(Al3+)+c(H+)=c(OH-)+2c((SO42-),因此有2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3-10-11;
(2)NH4Al(SO4)2中铵根离子和铝离子水解,溶液显酸性,是因为存在NH4++H2O![]() NH3·H2O+H+、Al3++3H2O
NH3·H2O+H+、Al3++3H2O![]() Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进水解,c(H+)
Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进水解,c(H+)
(3)NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-,H+结合OH-能力强于NH4+,在a点时通入NaOH的体积为100mL,恰好中和NH4HSO4电离出H+,因此离子反应方程式为H++OH-=H2O;(4)本题考查影响盐类水解的因素,Al3+、H+都抑制NH4+的水解,H+抑制NH4+水解能力强,即NH4HSO4溶液中c(NH4+)大。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
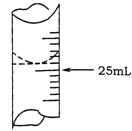
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数