题目内容
(14分)
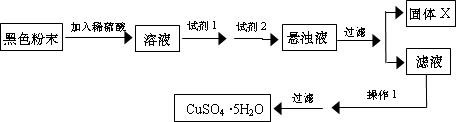
Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
|
实验步骤 |
预期现象和结论 |
|
|
|
|
|
|
【答案】
(14分)(1)红色粉末只含Cu2O (4分)
(2)假设1和假设3 (4分)
(3)(6分)
|
实验步骤 |
预期现象和结论 |
|
取少量(0.5~2 mL)小烧杯中的溶液于试管中,滴加1~2滴0.01 mol·L—1 KMnO4溶液,振荡。(2分) |
若溶液褪色,则假设3成立;(2分) 若溶液不褪色,则假设1成立。(2分) |
【解析】略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为测定某铁铜合金的组成,现将5.6g该合金(表面氧化膜成分为Fe2O3和CuO)加入到过量稀硫酸中,完全反应后产生气体672mL,并得到浅绿色溶液A(不含Cu2+离子)和不溶物B.过滤,将B加入到适量的某浓度的硝酸中,完全溶解后,得NO、NO2的混合气896mL,经测定该混合气中V(NO):V(NO2)=3:1.再将A也加入到足量同浓度的硝酸中充分反应,用排水法收集产生的气体结果得一烧瓶气体,(不从水中移出烧瓶)紧接着向烧瓶中通入224mL O2,气体能恰好完全溶于水(以上所有气体体积都已换算成标准状况时的数据).下列结论正确的是( )
| A、合金中氧元素的物质的量是0.01 mol | B、合金中铁单质的质量是1.68 g | C、溶液A中存在的阳离子只有Fe2+离子 | D、不溶物B为铜单质且质量是1.6 g |
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.