题目内容
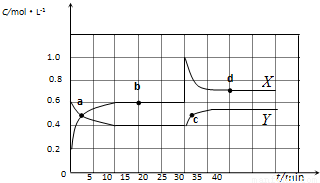
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 .
(2)①前10min内用NO2表示的化学反应速率v(NO2)= mol?L-1?min-1.
②反应2NO2(g)?N2O4(g)在b点的平衡常数K(b)= .
③反应2NO2(g)?N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d) K(b)(填“>”、“=”或“<”).
(3)①据图分析,在25min时采取的措施是 (填序号).
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是 .
【答案】分析:(1)根据反应方程式2NO2(g) N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;
N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;
物质的浓度不发生变化时表示化学反应处于平衡状态,根据图象判断处于平衡状态的点;
(2))①根据v=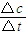 计算v(NO2);
计算v(NO2);
②平衡常数指达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据图读出平衡时各组分的平衡浓度,代入平衡常数表达式计算;
③25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,d点与b点的温度相同,温度不变平衡常数不变;
(3)①25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度;
②保持温度不变,快速缩小容器的体积至1L,反应混合物的浓度增大,颜色变深,同时压强增大平衡向正反应移动,二氧化氮的浓度又降低,但比原平衡浓度大,故颜色后变浅但比原平衡颜色深.
解答:解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态,
故答案为:X;b、d;
(2)①X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=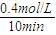 =0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;
=0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;
②由图可知,b点时各物质平衡浓度为c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,所以b点的平衡常数K(b)=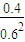 =
=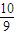 ,故答案为:
,故答案为: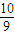 ;
;
③25min时瞬间,X的浓度增大,Y的浓度不变,只能是增大X的浓度,d点与b点的温度相同,平衡常数只受温度影响,温度不变平衡常数不变,故K(d)=K(b),
故答案为:=;
(3))①25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,即增大NO2 的浓度,故选:C;
②保持温度不变,快速缩小容器的体积至1L,反应混合物的浓度增大,颜色变深,同时压强增大平衡向正反应移动,二氧化氮的浓度又降低,但比原平衡浓度大,故颜色后变浅但比原平衡颜色深,故答案为:先变深后变浅,但比原平衡颜色深.
点评:本题考查平衡常数、平衡移动、平衡影响因素、化学平衡图象等,难度中等,图象问题解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少.(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律.
 N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;
N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此判断;物质的浓度不发生变化时表示化学反应处于平衡状态,根据图象判断处于平衡状态的点;
(2))①根据v=
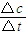 计算v(NO2);
计算v(NO2);②平衡常数指达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据图读出平衡时各组分的平衡浓度,代入平衡常数表达式计算;
③25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,d点与b点的温度相同,温度不变平衡常数不变;
(3)①25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度;
②保持温度不变,快速缩小容器的体积至1L,反应混合物的浓度增大,颜色变深,同时压强增大平衡向正反应移动,二氧化氮的浓度又降低,但比原平衡浓度大,故颜色后变浅但比原平衡颜色深.
解答:解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态,
故答案为:X;b、d;
(2)①X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=
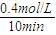 =0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;
=0.04mol?L-1?min-1,故答案为:0.04mol?L-1?min-1;②由图可知,b点时各物质平衡浓度为c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,所以b点的平衡常数K(b)=
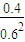 =
=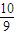 ,故答案为:
,故答案为: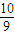 ;
;③25min时瞬间,X的浓度增大,Y的浓度不变,只能是增大X的浓度,d点与b点的温度相同,平衡常数只受温度影响,温度不变平衡常数不变,故K(d)=K(b),
故答案为:=;
(3))①25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,即增大NO2 的浓度,故选:C;
②保持温度不变,快速缩小容器的体积至1L,反应混合物的浓度增大,颜色变深,同时压强增大平衡向正反应移动,二氧化氮的浓度又降低,但比原平衡浓度大,故颜色后变浅但比原平衡颜色深,故答案为:先变深后变浅,但比原平衡颜色深.
点评:本题考查平衡常数、平衡移动、平衡影响因素、化学平衡图象等,难度中等,图象问题解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少.(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律.

练习册系列答案
相关题目
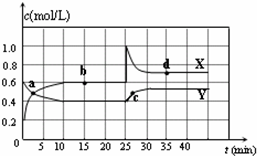 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A、图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | B、a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 | C、25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | D、前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L?min) |
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式 (2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
(2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( ) 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题:
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题: