题目内容
13.下列离子方程式书写正确的是( )| A. | NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | 往醋酸酸化的碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2═I2+2H2O | |
| D. | 氢硫酸里通入氯气:H2S+Cl2═2H++S↓+2Cl- |
分析 A.反应后溶液呈中性,则硫酸氢钠与氢氧化钡按照物质的量2:1反应;
B.氢氧化钠过量,碳酸氢根离子也参与反应;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.氯气能够将硫化氢氧化成碘单质.
解答 解:A.NaHSO4溶液中加Ba(OH)2溶液至中性,则硫酸氢钠与氢氧化钡按照物质的量2:1反应,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.往NH4HCO3溶液中加过量的NaOH溶液并加热,碳酸氢根离子和铵根离子都参与反应,正确的离子方程式为:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故B错误;
C.往醋酸酸化的碘化钾溶液中滴加适量的双氧水,醋酸不能拆开,正确的离子方程式为:2I-+2CH3COOH+H2O2═2CH3COO-+I2+2H2O,故C错误;
D.氢硫酸里通入氯气,二者发生氧化还原反应,反应的离子方程式为:H2S+Cl2═2H++S↓+2Cl-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列物质一定互为同系物的是( )
| A. | 12C和14C | B. | CH4和C2H6 | C. | C2H4和C3H6 | D. | O2和O3 |
4.有关乙酸与甲酸甲酯的说法中不正确的是( )
| A. | 两者都可以和NaOH溶液反应 | B. | 可利用水将两者区分开 | ||
| C. | 两者互为同分异构体 | D. | 两者互为同系物 |
1.下列措施能加快化学反应速率的是( )
| A. | 将食物放入冰箱 | B. | 向炉膛鼓风 | ||
| C. | 钨丝灯泡中抽成近真空 | D. | 食物袋中放入小包除氧剂 |
8.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )


| A. | 在一定条件下,能发生取代、酯化和加聚反应 | |
| B. | 该物质能使酸性KMNO4溶液褪色 | |
| C. | lmol该物质最多可与5molH2发生加成反应 | |
| D. | lmol该物质完全燃烧最多可消耗13mol氧气 |
18.下列物质中,不溶于水的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
5.如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )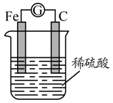

| A. | 电子从碳棒经导线流向铁棒 | B. | 铁棒是负极,碳棒是正极 | ||
| C. | 电池反应为:Fe+2H+=Fe2++H2↑ | D. | 碳棒上有气体放出,溶液c(H+)减小 |
16.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | N2电子式为: | B. | Cl-的结构示意图为: | ||
| C. | CO2的结构式为O-C-O | D. | 质量数为37的氯原子为${\;}_{37}^{17}$Cl |