题目内容
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。
(14分,每空2分) (1)1/3,向右进行 (2)CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol
(3)①0.225mol·L-1·min-1(单位和数值各1分) ②ac(对一个给1分,错一个倒扣1分)
(4)HCO3-水解程度大于其电离程度。
a=0.2(10-7+b)/b或a=(10-7+b)/5b(其他表示形式,只要正确均给分)
解析试题分析:(1) CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 1 2 0 0
转化浓度(mol/L) 0.5 0.5 0.5 0.5
平衡浓度(mol/L) 0.5 1.5 0.5 0.5
因为化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K=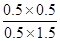 =
=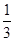 ;根据表中数据可知,升高温度,CO的转化率降低。这说明升高温度平衡向逆反应方向移动,因此平衡常数减小,所以850℃时的平衡常数大于
;根据表中数据可知,升高温度,CO的转化率降低。这说明升高温度平衡向逆反应方向移动,因此平衡常数减小,所以850℃时的平衡常数大于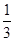 。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时Q=
。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时Q=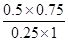 =
=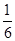 ,所以反应向右进行。
,所以反应向右进行。
(2)根据热化学方程式①C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1、②2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1、③C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1并依据盖斯定律可知①-②-③即得到CO(g)+H2O(g)=CO2(g)+H2(g),则该反应的反应热△H=-393.5kJ/mol+483.6kJ/mol-131.3kJ/mol=-41.2 kJ/mol。
(3)①根据图像可知,反应进行到10min时,反应达到平衡状态。此时生成甲醇的浓度是0.75mol/L,则根据方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,所以氢气的反应速率v(H2)=2.25mol/L÷10min=0.225mol·L-1·min-1。
②如果温度不变,改变条件使平衡向正反应方向移动,则平衡常数不变;由于正反应是放热反应,因此降低温度平衡向正反应方向进行,平衡常数增大,因此正确的答案选ac。
(4)由于HCO3-的水解程度大于HCO3-的电离程度,所以碳酸氢钠溶液显碱性。醋酸的酸性强于碳酸氢钠的,因此反应中有CO2气体生成。根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液显中性,则c(H+)=c(OH-)=10-7mol/L,所以c(CH3COO-)=c(Na+)=0.2mol/L÷2=0.1mol/L,所以溶液中c(CH3COOH)=0.5amol/L-c(CH3COO-)=0.5amol/L-0.1mol/L,所以根据电离平衡常数表达式可知b=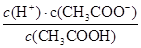 ,即b=
,即b=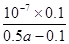 ,解得a=
,解得a=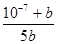 。
。
考点:考查平衡常数、反应热、电离平衡常数、反应速率的计算、热化学方程式的书写以及外界条件对平衡状态的影响、水解平衡和电离平衡的判断等

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案(14分)某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
| 实验 序号 | 温度/℃ | 时间/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为 mol/(L·min)。
(2)在实验2过程中,A的初始浓度c2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 v1,且c3 1.0 mol/L (填“<”、“>”或“=”)。
(4)比较实验4和实验l,可推测该反应是 反应(填“吸热”或“放热”)。理由是
。
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)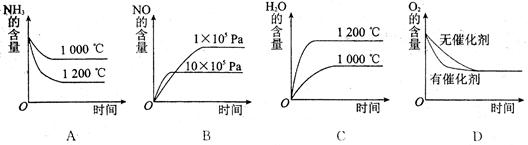
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起 始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | x | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸 吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
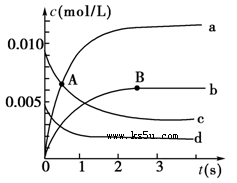
(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
 CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: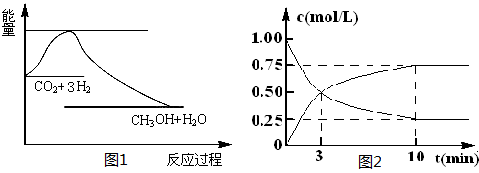
 CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=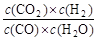 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H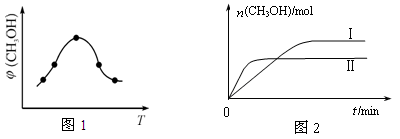
 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。